题目内容
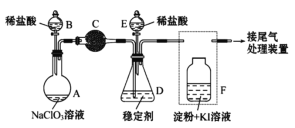
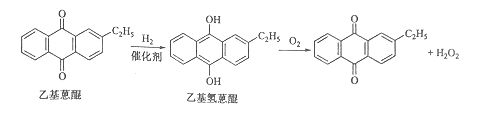
【题目】双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
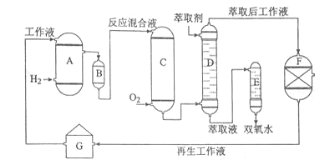
A.氢化釜 B.过滤器 C.氧化塔 D.萃取塔 E..净化塔 F.工作液再生装置 G.工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是_______,循环使用的原料是______,配制工作液时采用有机溶剂而不采用水的原因是______。
(2)氢化釜A中反应的化学方程式为_______,进入氧化塔C的反应混合液中的主要溶质为_______。
(3)萃取塔D中的萃取剂是____,选择其作萃取剂的原因是______。
(4)工作液再生装置F中要除净残留的H2O2,原因是______。
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为_______。一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为______mol/L。
【答案】氢气和氧气 乙基蒽醌 乙基蒽醌不溶于水,易溶于有机溶剂 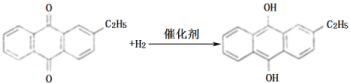 乙基氢蒽醌 水 过氧化氢易溶于水被水萃取,乙基蒽醌不溶于水 过氧化氢分解放出氧气,与氢气混合,易发生爆炸 6H++5H2O2+2MnO4-=2Mn2++5O2↑+8H2O 8.9
乙基氢蒽醌 水 过氧化氢易溶于水被水萃取,乙基蒽醌不溶于水 过氧化氢分解放出氧气,与氢气混合,易发生爆炸 6H++5H2O2+2MnO4-=2Mn2++5O2↑+8H2O 8.9
【解析】
乙基蒽醌溶于有机溶剂配制成工作液,工作液在A中催化加氢生成乙基氢蒽醌,乙基氢蒽醌在B中被氧气氧化成乙基蒽醌,同时生成过氧化氢,将生成过氧化氢后的混合液用水萃取,可得过氧化氢溶液,有机层主要含乙基蒽醌,通过再生装置处理可重新配制成工作液进行循环,整个过程中实际参加反应的只有氢气和氧气,据此解答。
(1)由转化反应可知,乙基蒽醌先与氢气发生加成反应生成乙基氢蒽醌,乙基氢蒽醌再与氧气发生氧化反应生成乙基蒽醌和过氧化氢,则蒽醌法制备双氧水理论上消耗的原料是氢气和氧气。乙基蒽醌开始被消耗,后来又生成,则循环使用的原料是乙基蒽醌,且结合流程图中再生工作液环节可知乙基蒽醌可循环使用,配制工作液时采用有机溶剂而不采用水的原因是乙基蒽醌不溶于水,易溶于有机溶剂,故答案为:氢气和氧气;乙基蒽醌;乙基蒽醌不溶于水,易溶于有机溶剂;
(2)由原理和流程可知,A中乙基蒽醌与氢气发生加成反应,反应为 ,进入氧化塔C的反应混合液中的主要溶质为产物乙基氢蒽醌,故答案为:
,进入氧化塔C的反应混合液中的主要溶质为产物乙基氢蒽醌,故答案为: ;乙基氢蒽醌;
;乙基氢蒽醌;![]() 中萃取分离出过氧化氢溶液,则选择萃取剂为水,选择其作萃取剂的原因是过氧化氢易溶于水被水萃取,乙基蒽醌不溶于水,故答案为:水;过氧化氢易溶于水被水萃取,乙基蒽醌不溶于水;
中萃取分离出过氧化氢溶液,则选择萃取剂为水,选择其作萃取剂的原因是过氧化氢易溶于水被水萃取,乙基蒽醌不溶于水,故答案为:水;过氧化氢易溶于水被水萃取,乙基蒽醌不溶于水;![]() 工作液再生装置F中要除净残留的
工作液再生装置F中要除净残留的![]() ,原因是过氧化氢分解放出氧气,与氢气混合,易发生爆炸,故答案为:过氧化氢分解放出氧气,与氢气混合,易发生爆炸;
,原因是过氧化氢分解放出氧气,与氢气混合,易发生爆炸,故答案为:过氧化氢分解放出氧气,与氢气混合,易发生爆炸;![]() 双氧水在酸性条件下与
双氧水在酸性条件下与![]() 溶液发生氧化还原反应生成氧气,离子反应为6H++5H2O2+2MnO4-=2Mn2++5O2↑+8H2O,由
溶液发生氧化还原反应生成氧气,离子反应为6H++5H2O2+2MnO4-=2Mn2++5O2↑+8H2O,由![]() 可知一种双氧水的质量分数为
可知一种双氧水的质量分数为![]() 密度为
密度为![]() ,其浓度=
,其浓度=![]() ,故答案为:6H++5H2O2+2MnO4-=2Mn2++5O2↑+8H2O;8.9。
,故答案为:6H++5H2O2+2MnO4-=2Mn2++5O2↑+8H2O;8.9。

 黄冈天天练口算题卡系列答案
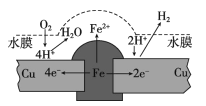
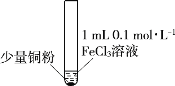
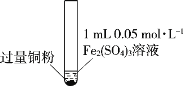
黄冈天天练口算题卡系列答案【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去, 变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是( )
A.实验I、II、III中均发生了反应2Fe3++Cu=2Fe2++Cu2+
B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.实验I、III中加入蒸馏水后c(Cu2+)相同
D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀