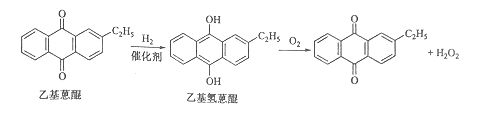
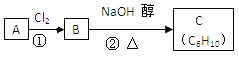
题目内容
【题目】ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛。
Ⅰ.实验室制备Cl2的离子方程式____________________________。
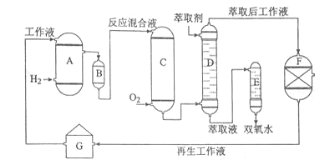
Ⅱ.某兴趣小组通过下图装置(夹持装置略)ClO2对制备、吸收、释放和应用进行了研究。
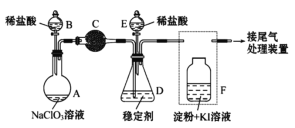
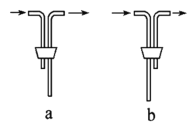
(1)仪器B的名称是___________。安装F中导管时,应选用上图中的_________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。为使ClO2 在D中被稳定剂充分吸收,滴加稀盐酸的速度宜___________ (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是___________ 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为__________________,装置F中的现象是________________ 。
【答案】MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑ 分液漏斗 b 慢 吸收Cl2 4H++5ClO2-=Cl-+4ClO2↑+2H2O 淀粉碘化钾溶液变蓝
Mn2++2H2O+Cl2↑ 分液漏斗 b 慢 吸收Cl2 4H++5ClO2-=Cl-+4ClO2↑+2H2O 淀粉碘化钾溶液变蓝
【解析】
二氧化锰与浓盐酸在加热的条件下反应生成氯化锰、氯气和水。装置A中盛放NaClO3溶液,装置B盛放稀盐酸,两者混合发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,装置C的作用是吸收Cl2,除去氯气,ClO2在装置D中被稳定剂完全吸收生成NaClO2,在酸性条件下NaClO2可发生反应4H++5ClO2-=Cl-+4ClO2↑+2H2O生成NaCl并释放出ClO2,装置F检验二氧化氯中氯气是否完全被装置C吸收,据此分析。
Ⅰ.二氧化锰与浓盐酸在加热的条件下反应生成氯化锰、氯气和水,实验室制备Cl2的离子方程式为:MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑;
Mn2++2H2O+Cl2↑;
Ⅱ.(1)根据仪器的形状可知,仪器B的名称是分液漏斗;根据操作分析,F装置应是氯气和KI 反应,所以应长管进气,短管出气,选b;
(2)为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度要慢;
(3)F装置中发生反应Cl2+2KI=2KCl+I2,碘遇淀粉变蓝,所以F中溶液的颜色不变,则装置C的作用是吸收Cl2;
(4)在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 4H++5ClO2-=Cl-+4ClO2↑+2H2O;二氧化氯是一种强氧化剂,与碘化钾反应将生成碘、氯化钾和盐酸,淀粉溶液遇到碘会变成蓝色,实验现象是溶液变成蓝色。

【题目】已知:① X、Y、Z、W、R、Q为原子序数依次增大的短周期元素。X 是所有元素中原子半径最小的元素,Y是形成化合物种类最多的元素,W的最外层电子数是次外层电子数的3倍,Q与W同主族,Y、R原子的最外层电子数之和等于Z的最外层电子数。
②莱纳斯·卡尔·鲍林在1932年提出electronegativity作为元素原子在化合物某种性质的标度,electronegativity的大小可以判断元素金属性与非金属性强弱,下表列出部分短周期元素的Electronegativity的值。
元素 | X | Y | Z | W | R | Q |
electronegativity | 2.1 | 2.5 | 3.0 | 3.5 | 0.9 | 2.5 |
元素 | Mg | Li | Al | Cl | P | Be |
electronegativity | 1.2 | 1.0 | 1.5 | 3.0 | 2.1 | 1.5 |
请回答下列问题(涉及X、Y、Z、W、R、Q时,用元素符号表示):
(1)根据上表给出的数据,可知元素的electronegativity越大,__(填“金属性”或“非金属性”)越强。
(2)元素Q在周期表中的位置为_________。
(3)W、R、Q单核简单离子半径由大到小排列顺序为______。
(4)元素X、Z、W之间能形成多种10电子微粒,请写出反应物和产物均为X、Z、W之间形成的10电子微粒的一个离子方程式______________。
(5)一种由元素W、R组成的白色固体化合物,其电子式为_______________。
(6)试比较稳定性:X2W_____ X2Q;沸点:X2W_____ X2Q (填“<”或“>”)。
(7)元素 X、Y、Z、W、R、Q中的两种元素可形成原子个数比为1∶2的共价化合物,则这两种元素的原子序数之差不可能是_________。
A.2 B.4 C.5 D.7