题目内容
【题目】以饱和食盐水、NH3和CO2为原料,可以制取纯碱。下列说法正确的是( )
A.由反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0可知反应物所含键能总和大于生成物所含键能总和
2NH3(g) ΔH<0可知反应物所含键能总和大于生成物所含键能总和
B.常温常压下,电解饱和食盐水时,每生成2.24LCl2,电路中转移0.2mol电子
C.室温下,稀释纯碱溶液时,溶液的pH减小
D.反应Na2O(s)+CO2(g)=Na2CO3(s)常温下可自发进行,该反应为吸热反应
【答案】C
【解析】
A. ΔH<0为放热反应,反应物所含键能总和小于生成物所含键能总和,A项错误;
B.常温常压下,电解饱和食盐水得到2.24LCl2物质的量不是0.1mol,转移电子也不是0.1mol,B项错误;
C.室温下,稀释纯碱溶液时,碱性减弱溶液的pH减小,C项正确;
D.反应Na2O(s)+CO2(g)=Na2CO3(s),ΔS<0,若常温下可自发反应,则ΔG=ΔH-TΔS<0,ΔH<0为放热反应,D项错误;
答案选C。

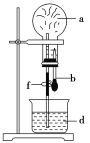
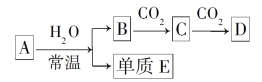
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )
选项 | a(干燥气体) | b(液体) |
|
A | NO2 | 水 | |
B | CO2 | 饱和NaHCO3溶液 | |
C | Cl2 | 饱和NaCl溶液 | |
D | NH3 | 1 mol·L-1盐酸 |
A. AB. BC. CD. D
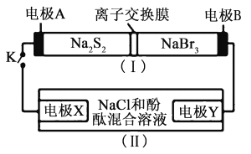
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为___,电池反应的离子方程式为___。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn___g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过___分离回收;滤渣的主要成分是MnO2、___和_______,欲从中得到较纯的MnO2,最简便的方法是___,其原理是___。
【题目】已知:① X、Y、Z、W、R、Q为原子序数依次增大的短周期元素。X 是所有元素中原子半径最小的元素,Y是形成化合物种类最多的元素,W的最外层电子数是次外层电子数的3倍,Q与W同主族,Y、R原子的最外层电子数之和等于Z的最外层电子数。
②莱纳斯·卡尔·鲍林在1932年提出electronegativity作为元素原子在化合物某种性质的标度,electronegativity的大小可以判断元素金属性与非金属性强弱,下表列出部分短周期元素的Electronegativity的值。
元素 | X | Y | Z | W | R | Q |
electronegativity | 2.1 | 2.5 | 3.0 | 3.5 | 0.9 | 2.5 |
元素 | Mg | Li | Al | Cl | P | Be |
electronegativity | 1.2 | 1.0 | 1.5 | 3.0 | 2.1 | 1.5 |
请回答下列问题(涉及X、Y、Z、W、R、Q时,用元素符号表示):
(1)根据上表给出的数据,可知元素的electronegativity越大,__(填“金属性”或“非金属性”)越强。
(2)元素Q在周期表中的位置为_________。
(3)W、R、Q单核简单离子半径由大到小排列顺序为______。
(4)元素X、Z、W之间能形成多种10电子微粒,请写出反应物和产物均为X、Z、W之间形成的10电子微粒的一个离子方程式______________。
(5)一种由元素W、R组成的白色固体化合物,其电子式为_______________。
(6)试比较稳定性:X2W_____ X2Q;沸点:X2W_____ X2Q (填“<”或“>”)。
(7)元素 X、Y、Z、W、R、Q中的两种元素可形成原子个数比为1∶2的共价化合物,则这两种元素的原子序数之差不可能是_________。
A.2 B.4 C.5 D.7