题目内容
【题目】FeCl3是重要的化工原料,无水氯化铁在300℃时升华,极易潮解。
I.制备无水氯化铁。
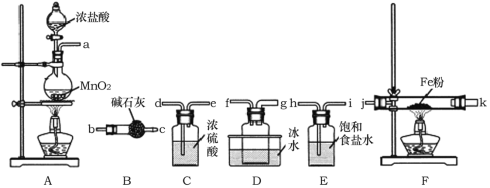
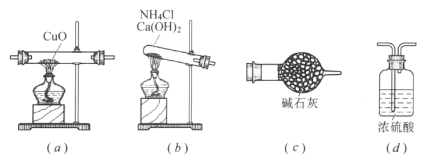
(1)A装置中发生反应的离子方程式为______________。
(2)装置的连接顺序为a→______________→j,k→______________(按气流方向,用小写字母表示)。
(3)实验结束后,取少量F装置玻璃管中的固体加水溶解,经检测,发现溶液中含有Fe2+,可能原因为______________。
II.探究FeCl3与SO2的反应。
(4)已知反应体系中存在下列两种化学变化:
(i)Fe3+与SO2发生络合反应生成Fe(SO2)63+(红棕色);
(ii)Fe3+与SO2发生氧化还原反应,其离子方程式为______________。
(5)实验步骤如下,并补充完整。
步骤 | 现象 | 结论 |
①取5mL1mol·L-1FeCl3溶液于试管中,通入SO2至饱和。 | 溶液很快由黄色变为红棕色 | |
②用激光笔照射步骤①中的红棕色液体。 | _______________ | 红棕色液体不是Fe(OH)3胶体 |
③将步骤①中的溶液静置。 | 1小时后,溶液逐渐变为浅绿色 | |
④向步骤③中溶液加入2滴___________ 溶液(填化学式)。 | _______________ | 溶液中含有Fe2+ |
(6)从上述实验可知,反应(i)、(ii)的活化能大小关系是:E(i)________E(ii)(填“>”、“<”或“=”,下同),平衡常数大小关系是:K(i)__________K(ii)。
【答案】MnO2+2Cl+4H+![]() Mn2++Cl2↑+2H2O h,i,d,e g,f,b,(c) 未升华出来的FeCl3与未反应完的铁粉在水溶液中反应生成Fe2+ SO2+2H2O+2Fe3+===SO42-+4H++2Fe2+ 液体中无明显光路 K3[Fe(CN)6] 生成蓝色沉淀 ﹤ ﹤
Mn2++Cl2↑+2H2O h,i,d,e g,f,b,(c) 未升华出来的FeCl3与未反应完的铁粉在水溶液中反应生成Fe2+ SO2+2H2O+2Fe3+===SO42-+4H++2Fe2+ 液体中无明显光路 K3[Fe(CN)6] 生成蓝色沉淀 ﹤ ﹤
【解析】
Ⅰ首先制取氯气,然后除杂、干燥,再与铁粉反应,冷凝法收集升华出的FeCl3,最后连接盛有碱石灰的干燥剂,吸收多余的氯气,防止空气中的水蒸气使FeCl3水解。F中剩余的固体可能为未升华的FeCl3和铁粉的混合物,溶于水发生反应生成FeCl2;
Ⅱ①Fe3+与SO2发生氧化还原反应生成Fe3+和SO42-,根据得失电子守恒、电荷守恒和原子守恒写出离子方程式;
②没有出现丁达尔现象,说明红棕色物质不是Fe(OH)3胶体;
③用K3Fe(CN)6溶液检验Fe2+,生成蓝色沉淀;
④反应(i)比反应(ii)快,则活化能E(i)<E(ii);反应(ii)进行的程度更大,则平衡常数K(i)<K(ii);
Ⅰ(1)反应的离子方程式为:MnO2+2Cl+4H+![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)首先制取氯气,然后除杂、干燥,导管应长进短出,所以a连接h,i连接d;在F中与铁粉反应,为防止FeCl3堵塞导管,应用粗导管,则e连接j,冷凝法收集升华出的FeCl3,所以k连接g;最后连接盛有碱石灰的干燥管,吸收未反应的氯气;
(3)实验结束后,去少量F中的固体加水溶解,经检测发现溶液中含有Fe2+,其原因为未升华出来的FeCl3与未反应的Fe发生反应生成Fe2+;
Ⅱ(4)Fe3+与SO2发生氧化还原反应生成Fe3+和SO42-,根据得失电子守恒、电荷守恒和原子守恒,离子方程式为SO2+2H2O+2Fe3+===SO42-+4H++2Fe2+;
(5)没有出现丁达尔现象,说明红棕色物质不是Fe(OH)3胶体;
(6)由实验现象可知,FeCl3与SO2首先发生反应(i),说明反应(i)比反应(ii)快,则活化能E(i)<E(ii);反应最终得到Fe2+,反应(ii)进行的程度更大,则平衡常数K(i)<K(ii)。

 阅读快车系列答案
阅读快车系列答案【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)CO还原NO的反应为2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)H=-746kJ·mol-1。
2CO2(g)+N2(g)H=-746kJ·mol-1。
写出两条有利于提高NO平衡转化率的措施______________、______________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
H。恒容恒温条件下,向体积相同的甲、乙、丙三个容器中分别加入足量的焦炭和一定量的NO,测得各容器中NO的物质的量[n(NO)]随反应时间(t)的变化情况如表所示:
t/min n(NO)/mol 容器 | 0 | 40 | 80 | 120 | 160 |
甲/400℃ | 2.00 | 1.5 | 1.10 | 0.80 | 0.80 |
乙/400℃ | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙/T℃ | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①H______________0(填“>”或“<”);
②乙容器在160min时,v正_________v逆(填“>”、“<”或“=”)。
(3)某温度下,向体积为2L的恒容真空容器中通入2.0molNO2,发生反应:2NO2(g)![]() N2O4(g)H=-57.0kJ·mol-1,已知:v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数。测得NO2的体积分数[x(NO2)]与反应时间(t)的关系如表:
N2O4(g)H=-57.0kJ·mol-1,已知:v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数。测得NO2的体积分数[x(NO2)]与反应时间(t)的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 |
x(NO2) | 1.0 | 0.75 | 0.52 | 0.50 | 0.50 |
①![]() 的数值为______________;
的数值为______________;
②已知速率常数k随温度升高而增大,则升高温度后k1增大的倍数___________k2增大的倍数(填“>”、“<”或“=”)。
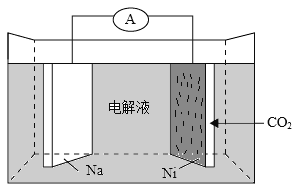
(4)用间接电化学法除去NO的过程,如图所示:
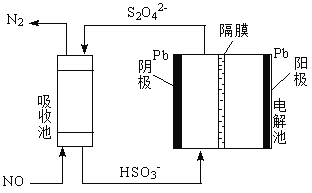
①已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:______________;
②用离子方程式表示吸收池中除去NO的原理:______________。
【题目】在800℃2L密闭容器中,反应2NO+O2![]() 2NO2,n(NO)随时间的变化如下表:
2NO2,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示各物质浓度的变化曲线。
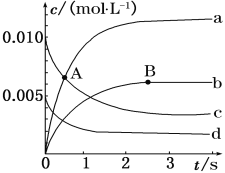
A点处,v(正)__v(逆),A点正反应速率__B点正反应速率。(用“>”、“<”、“=”填空)
(2)图中表示O2变化的曲线是__。用NO2表示从0~2s内该反应的平均速率v=__。
(3)能使该反应的反应速率增大的是__。
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4)能说明该反应已经达到平衡状态的是__。
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)