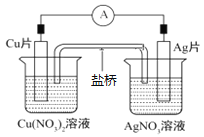
题目内容
【题目】铜的相关化合物在化工、材料等领域有着广泛的应用。回答下列问题:
(1)基态Cu原子中,核外电子占据的最高能层的符号是___________,占据该能层电子的电子云轮廓图形状为__________;Cu2+价层电子的电子排布图为___________。
(2)离子晶体中Cu2O熔点比Cu2S熔点高,其原因是___________________________。
(3)Cu可与N、S,O等元素形成化合物,N、S、O三种元素的第一电离能由大到小的顺序为______________;在Cu的催化作用下,乙醇可被氧化为乙醛,乙醛分子中碳原子的杂化方式是________________。
(4)1mo[Cu(NH3)4]SO4中含有σ键的数目为___________。
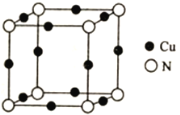
(5)Cu与N所形成的某种晶体的立方晶胞如图所示,其晶胞参数为anm。该晶体的化学式为___________,晶体的密度为___________g·cm-3(列出计算式即可,用NA表示阿伏加德罗常数)。
【答案】N 球形 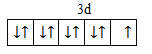 Cu2O与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高 N>O>S sp3 sp2 20NA Cu3N 2.06×1023/(NA×a3)
Cu2O与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高 N>O>S sp3 sp2 20NA Cu3N 2.06×1023/(NA×a3)
【解析】
(1)根据基态Cu原子核外电子数为29,基态原子核外电子排布为[Ar]3d104s1,以此确定;
(2)离子半径越小,离子所带电荷数越多,晶格能越大,熔点越高;
(3)非金属性越强,第一电离能越大,但N元素的最外层电子处于半满状态,是一种稳定结构,所以它的第一电离能高于同周期相邻的元素;乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,所以甲基中的碳原子采用sp3杂化,醛基中的碳原子采用sp2杂化;
(4)1个配离子中,4个N与Cu2+形成4条σ键,N、H间形成3×4=12条,共16条,1mol[Cu(NH3)4]2+中σ键的物质的量16mol,数目为16NA;1个SO42-中含有4条σ键,则1molSO42-中含有4molσ键,数目为4NA;因此1mo[Cu(NH3)4]SO4中含有σ键的数目为20NA;
(5)晶胞中,顶点微粒是8个晶胞共用,棱上微粒是四个晶胞共用,面上微粒是两个晶胞共用;计算出一个晶胞的质量和体积,即可计算密度;
(1)基态Cu原子核外电子数为29,基态原子核外电子排布为[Ar]3d104s1,最高能层的符号是N,占据该能层电子的电子云轮廓图形状为球形;Cu2+价层电子的电子排布图为 ;
;
答案: N 球形 
(2)由于氧离子的离子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高;
答案: Cu2O与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高
(3)同一主族中,从上向下,元素第一电离能逐渐减小,同一周期中,元素的第一电离能随着原子序数的增大而增大,但N元素的最外层电子处于半满状态,是一种稳定结构,所以它的第一电离能高于同周期相邻的元素,所以N、O、S四种元素的第一电离能由小到大的顺序为S<O<N;乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,所以甲基中的碳原子采用sp3杂化,醛基中碳原子采用sp2杂化;
答案:N>O>S sp3 sp2
(4)1个配离子中,4个N与Cu2+形成4条σ键,N、H间形成3×4=12条,共16条,1mol[Cu(NH3)4]2+中σ键的物质的量16mol,数目为16NA;1个SO42-中含有4条σ键,则1molSO42-中含有4molσ键,数目为4NA;因此1mo[Cu(NH3)4]SO4中含有σ键的数目为20NA;
答案:20NA
(5)1个晶胞中含有Cu:12×1/4=3,含有N:8×1/8=1,该晶体的化学式为Cu3N;1个晶胞的质量为![]() =
=![]() ,1个晶胞的体积为(a×10-7)3cm3,因此密度为
,1个晶胞的体积为(a×10-7)3cm3,因此密度为 =2.06×1023/(NA×a3);
=2.06×1023/(NA×a3);
答案:Cu3N 2.06×1023/(NA×a3)

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】FeCl3是重要的化工原料,无水氯化铁在300℃时升华,极易潮解。
I.制备无水氯化铁。
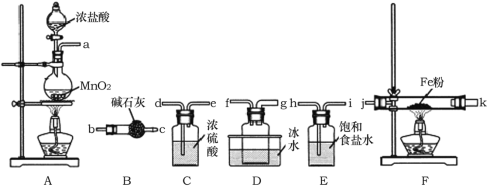
(1)A装置中发生反应的离子方程式为______________。
(2)装置的连接顺序为a→______________→j,k→______________(按气流方向,用小写字母表示)。
(3)实验结束后,取少量F装置玻璃管中的固体加水溶解,经检测,发现溶液中含有Fe2+,可能原因为______________。
II.探究FeCl3与SO2的反应。
(4)已知反应体系中存在下列两种化学变化:
(i)Fe3+与SO2发生络合反应生成Fe(SO2)63+(红棕色);
(ii)Fe3+与SO2发生氧化还原反应,其离子方程式为______________。
(5)实验步骤如下,并补充完整。
步骤 | 现象 | 结论 |
①取5mL1mol·L-1FeCl3溶液于试管中,通入SO2至饱和。 | 溶液很快由黄色变为红棕色 | |
②用激光笔照射步骤①中的红棕色液体。 | _______________ | 红棕色液体不是Fe(OH)3胶体 |
③将步骤①中的溶液静置。 | 1小时后,溶液逐渐变为浅绿色 | |
④向步骤③中溶液加入2滴___________ 溶液(填化学式)。 | _______________ | 溶液中含有Fe2+ |
(6)从上述实验可知,反应(i)、(ii)的活化能大小关系是:E(i)________E(ii)(填“>”、“<”或“=”,下同),平衡常数大小关系是:K(i)__________K(ii)。