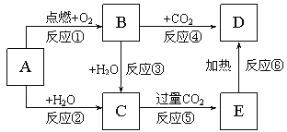
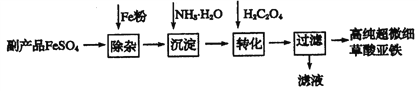
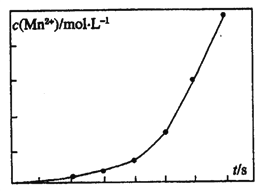
题目内容
【题目】按要求回答下列问题:
(1)当H2O和H2O2分子个数比为1:1 时,原子总数之比为_____________,电子数之比为________________。
(2)V mLAl2(SO4)3溶液中含a gAl3+,取出V/4 mL溶液稀释成V mL后,SO42-的物质的量浓度为______________(用含a、V的代数式表示,化简到最简整数比)。
(3)在一定条件下,11.2 g单质R与0.3 molCl2完全反应,生成0.2 molRClx,则x=______,RClx 的摩尔质量为_______________。
【答案】3:4 5:9 125a/9Vmol/L 3 162.5g/mol
【解析】
(1)当H2O和H2O2分子个数比为1:1 时,原子总数之比为![]() ,电子数之比为
,电子数之比为![]() ;
;
(2)ag Al3+ 的物质的量为 ![]() =
= ![]() mol,故
mol,故 ![]() mL溶液中Al3+ 的物质的量为
mL溶液中Al3+ 的物质的量为 ![]() mol×
mol×![]() =
= ![]() mol,根据电荷守恒可知2n(SO42- )=3n(Al3+ ),故
mol,根据电荷守恒可知2n(SO42- )=3n(Al3+ ),故![]() mL溶液中SO42- 的物质的量为
mL溶液中SO42- 的物质的量为
![]() mol×
mol× ![]() =
= ![]() mol,取
mol,取 ![]() mL溶液稀释到V mL,则稀释后溶液SO42- 的物质的量浓度为
mL溶液稀释到V mL,则稀释后溶液SO42- 的物质的量浓度为 ![]() =
= ![]() mol/L;
mol/L;
(3)根据质量守恒,0.2mol RClx中含有0.2molR和0.2xmolCl,因为0.3 molCl2中含有0.6molCl,所以0.2xmol=0.6mol,解得x=3,11.2 g的物质的量为0.2mol,R的摩尔质量为:![]() =56g/mol,RClx 即RCl3 的摩尔质量为(56+3
=56g/mol,RClx 即RCl3 的摩尔质量为(56+3![]() )g/mol = 162.5g/mol。
)g/mol = 162.5g/mol。

练习册系列答案
相关题目