题目内容
【题目】(一)铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表中第___族,其基态原子中未成对电子的个数为_________。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________,尿素分子中C、N原子的杂化方式分别是_____、___,其分子中σ键与π键的数目之比为___,所含非金属元素的电负性由大到小的顺序是_______。
(二)已知元素镓和砷的单质及其化合物在工业生产上有重要的用途。回答下列问题:
(1)砷元素基态原子的电子排布式为_____________。
(2)砷与氢元素。可形成化合物砷化氢,该化合物的空间构型为_____,其中砷原子的杂化方式为__________。
(3)根据等电子原理,写出由短周期元素组成且与砷化氢互为等电子体的一种离子的化学式__________。
【答案】 VIII 3 [Ar]3d5(或1s2s2p63s3p63d5) sp2 sp3 7:1 O>N>C>H ls22s22p63s23p63d104s24p3 三角锥型 sp3 H3O+
【解析】(一)考查洪特规则、电子排布式的书写、杂化类型的判断、化学键的数目、电负性的规律(1)Co位于第四周期VIII族,27号元素,基态原子钴电子排布式为[Ar]3d74s2,根据洪特规则,未成对电子数为3;(2)基态铁原子的电子排布式为[Ar]3d64s2,即Fe3+的电子排布式为[Ar]3d5或1s2s2p63s3p63d5;尿素的结构简式为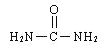 ,C有3个σ键,无孤电子对,因此C的杂化类型为sp2,N原子全部都是单键,杂化类型为sp3,成键原子之间只能形成一个σ键,双键有一个π键,因此σ键与π键的数目之比为7:1;同周期从左向右电负性增大,即电负性大小顺序是O>N>C>H;(二)考查空间构型、等电子体,(1)As位于第四周期VA,即基态砷原子的电子排布式为ls22s22p63s23p63d104s24p3;(2)砷化氢的分子式为AsH3,中心原子As有3个σ键,孤电子对数为(5-3×1)/2=1,杂化类型为sp3,空间构型为三角锥形;(3)根据等电子体的定义,与AsH3等电子体的分子,其中一种为NH3,推出与AsH3互为等电子体的离子可能是H3O+、CH3+等。
,C有3个σ键,无孤电子对,因此C的杂化类型为sp2,N原子全部都是单键,杂化类型为sp3,成键原子之间只能形成一个σ键,双键有一个π键,因此σ键与π键的数目之比为7:1;同周期从左向右电负性增大,即电负性大小顺序是O>N>C>H;(二)考查空间构型、等电子体,(1)As位于第四周期VA,即基态砷原子的电子排布式为ls22s22p63s23p63d104s24p3;(2)砷化氢的分子式为AsH3,中心原子As有3个σ键,孤电子对数为(5-3×1)/2=1,杂化类型为sp3,空间构型为三角锥形;(3)根据等电子体的定义,与AsH3等电子体的分子,其中一种为NH3,推出与AsH3互为等电子体的离子可能是H3O+、CH3+等。

 名校课堂系列答案
名校课堂系列答案