题目内容
【题目】下列有关说法中正确的是( )
A. 主族元素的电负性越大,元素原子的第一电离能一定越大
B. 在元素周期表中,元素电负性从左到右越来越大
C. 金属元素电负性一定小于非金属元素电负性
D. 在形成化合物时,电负性越小的元素越容易显示正价
【答案】D
【解析】A项,主族元素的电负性越大,元素原子的第一电离能不一定越大,如电负性:O![]() N,第一电离能:N
N,第一电离能:N![]() O,A项错误;B项,对于主族元素,同周期从左到右电负性逐渐增大,过渡元素没有明显变化规律,B项错误;C项,金属元素电负性不一定小于非金属元素电负性,如Si的电负性为1.8,Pb的电负性为1.9等,过渡元素中很多金属元素的电负性大于非金属元素的电负性,C项错误;D项,在形成化合物时,电负性越小的元素对电子的吸引能力越弱,元素的化合价显示正价,电负性越大的元素对电子的吸引能力越强,元素的化合价显示负价,D项正确;答案选D。
O,A项错误;B项,对于主族元素,同周期从左到右电负性逐渐增大,过渡元素没有明显变化规律,B项错误;C项,金属元素电负性不一定小于非金属元素电负性,如Si的电负性为1.8,Pb的电负性为1.9等,过渡元素中很多金属元素的电负性大于非金属元素的电负性,C项错误;D项,在形成化合物时,电负性越小的元素对电子的吸引能力越弱,元素的化合价显示正价,电负性越大的元素对电子的吸引能力越强,元素的化合价显示负价,D项正确;答案选D。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】H2Y2-是乙二胺四乙酸根(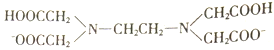 )的简写,可与多种金属离子形成络合物。
)的简写,可与多种金属离子形成络合物。
I. H2Y2-与Fe2+形成的络合物FeY2-可用于吸收烟气中的NO。其吸收原理:
FeY2-(aq)+NO(g)![]() FeY2-(NO)(aq) △H<0
FeY2-(NO)(aq) △H<0
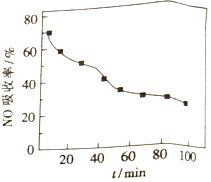
(1)将含NO的烟气以一定的流速通入起始温度为50℃的FeY2-溶液中。NO吸收率随通入烟气的时间变化如右图。时间越长,NO吸收率越低的原因是_________。
(2)生成的FeY2-(NO)(aq)可通过加入铁粉还原再生,其原理:FeY2-(NO)(aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3(未配平)。
若吸收液再生消耗14g铁粉,则所吸收的烟气中含有NO的物质的量为_______。
II.络合铜(CuY2-)废水的处理一直是环境工程领域的研究热点。
(1)H2Y2-与Cu2+、Fe3+、Ca2+络合情况如下表:
络合反应 | lgK(K为平衡常数) |
Cu2++H2Y2- | 18.8 |
Fe3++H2Y2- | 25.1 |
Ca2++H2Y2- | 10.7 |
①表中最不稳定的金属络合物是_____(填化学式)。向含有络合铜(CuY2-)废水中加入一种黄色的盐溶液A可解离出Cu2+,则盐A中阳离子为________(填化学式)。
②调节pH可将解离出的Cu2+转化为Cu(OH)2沉淀,若要使c(Cu2+)≤2.2×10-4mol/L,pH应不低于________(常温下Ksp[Cu(OH)2]= 2.2×10-20)。
(2)羟基自由基(-OH)、Na2FeO2都可氧化络合铜中的Y4-而使Cu2+得到解离。
①酸性条件下,-OH可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2。该反应的离子方程式为___________________。
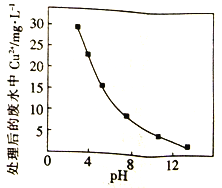
②Na2FeO4在酸性条件下不稳定。用Na2FeO4处理后的废水中Cu2+的浓度与pH的关系如右图。pH越大,/span>废水处理效果越好,这是因为______________。