题目内容
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。
请回答下列问题。
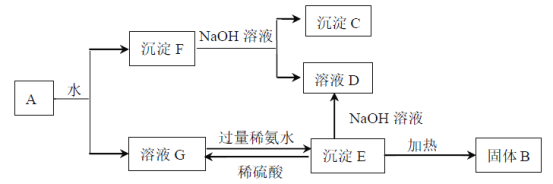
(1)图中涉及分离溶液与沉淀的方法是______________________________。
(2)B、C、D、E4种物质的化学式为:B___________、C___________、D___________、E___________。
(3)沉淀F与NaOH溶液反应的离子方程式为_________________________________。溶液G与过量稀氨水反应的化学方程式为____________________________________。
【答案】过滤 Al2O3 Fe2O3 NaAlO2 Al(OH)3 Al2O3+2OH-= 2AlO2-+H2O Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2 SO4
【解析】
Al2(SO4)3易溶于水,Al2O3、Fe2O3难溶于水,所以沉淀F是Al2O3、Fe2O3, G是Al2(SO4)3溶液;
Al2O3与氢氧化钠溶液反应生成偏铝酸钠,Fe2O3与氢氧化钠溶液不反应,所以沉淀C是Fe2O3、D是偏铝酸钠溶液;Al2(SO4)3与过量氨水反应生成氢氧化铝沉淀和硫酸铵,则E是Al(OH)3,Al(OH)3加热分解为Al2O3;Al(OH)3与氢氧化钠反应生成偏铝酸钠溶液。
(1)固体与液体分离用过滤法,图中涉及分离溶液与沉淀的方法是过滤。
(2)根据以上分析,B是氧化铝,化学式是Al2O3;C是氧化铁,化学式是Fe2O3;D是偏铝酸钠,化学式是NaAlO2;E是氢氧化铝,化学式是Al(OH)3。
(3)沉淀F中的Al2O3与NaOH溶液反应生成偏铝酸钠,反应的离子方程式为Al2O3+2OH-= 2AlO2-+H2O。G是Al2(SO4)3溶液,与过量稀氨水反应生成氢氧化铝沉淀和氯化铵,反应的化学方程式为Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2 SO4。

 小学课时特训系列答案
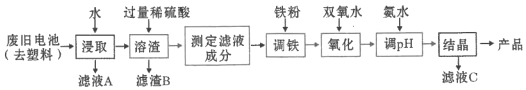
小学课时特训系列答案【题目】钒是地壳中含量第21丰富元素,是人体必需的微量元素,对治疗糖尿病和癌症及保护心血管等具有潜在的药理学作用。工业上用含三价钒![]() 为主的某石煤为原料(含有
为主的某石煤为原料(含有![]() 、CaO等杂质),钙化法焙烧制备
、CaO等杂质),钙化法焙烧制备![]() ,其流程如下:
,其流程如下:
![]()
已知:+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 |
|
|
|
|
(1)焙烧:向石煤中加生石灰焙烧,将![]() 转化为
转化为![]() 的化学方程式是________________。
的化学方程式是________________。
(2)酸浸:![]() 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的![]() ,
,![]() 溶于盐酸的离子方程式是________________。
溶于盐酸的离子方程式是________________。
(3)转沉:将浸出液中的钒转化为![]() 固体,其流程如下:
固体,其流程如下:
![]()
①浸出液中加入石灰乳的作用是____________________________________。
②向![]() 溶液中加入
溶液中加入![]() 溶液,控制溶液的
溶液,控制溶液的![]() 。当
。当![]() 时,
时,![]() 的产量明显降低,原因是_______________________________________。
的产量明显降低,原因是_______________________________________。
(4)实验室以![]() 为原料还可以合成用于制备
为原料还可以合成用于制备![]() 的氧钒(IV)碱式碳酸铵晶体,过程如下:
的氧钒(IV)碱式碳酸铵晶体,过程如下:
![]()
①步骤ⅱ可在如图装置(气密性良好)中进行。已知:![]() 能被
能被![]() 氧化。
氧化。
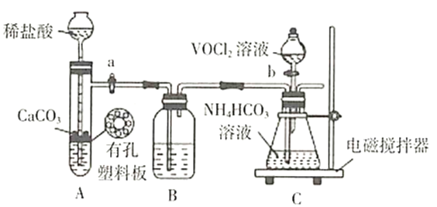
药品填装完成后的实验操作是________(填“活塞a”、“活塞b”的操作顺序),装置B中的试剂是________。
②测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。
称量4.246g样品于锥形瓶中,用20mL蒸馏水与30mL硫酸混合溶解后,加![]() 的
的![]() 溶液至稍过量,充分反应后继续加1%
溶液至稍过量,充分反应后继续加1%![]() 溶液至稍过量,再用尿素除去过量的
溶液至稍过量,再用尿素除去过量的![]() ,最后用
,最后用![]() 的
的![]() 标准溶液滴定至终点,消耗体积为30.00mL(滴定反应:
标准溶液滴定至终点,消耗体积为30.00mL(滴定反应: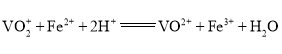 )。
)。
![]() 溶液的作用是________________,粗产品中钒的质量分数为________________(精确到小数点后两位)。
溶液的作用是________________,粗产品中钒的质量分数为________________(精确到小数点后两位)。