��Ŀ����
����Ŀ����������Ҫ������ȼ�Ϻͻ���ԭ�ϡ��ش��������⣺
(1)��֪![]() ��
��![]() ��
��![]() ��ȼ���ȷֱ�Ϊ
��ȼ���ȷֱ�Ϊ![]() ��
��![]() ,
,![]() �����ü����Ʊ��ϳ����ķ�ӦΪ
�����ü����Ʊ��ϳ����ķ�ӦΪ![]()
![]() ��
��
�������������ܷ����![]() ________(����������������)��������________________��
________(����������������)��������________________��
(2)��ij�ܱ�������ͨ��![]()
![]() ��
��![]() ���ڲ�ͬ�����·�����Ӧ��
���ڲ�ͬ�����·�����Ӧ��
![]()
![]()
���ƽ��ʱ![]() ������������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
������������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
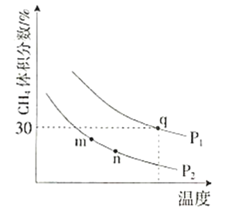
��![]() ________
________![]() ��
��![]() ________(����<������>������=��)��
________(����<������>������=��)��
��m��n��q����Ļ�ѧƽ�ⳣ����С��ϵΪ________��
��q������ת����Ϊ________���������µĻ�ѧƽ�ⳣ��![]() ________(�ú���
________(�ú���![]() �ı���ʽ��ʾ��
�ı���ʽ��ʾ��![]() Ϊ�Է�ѹ��ʾ��ƽ�ⳣ��)��
Ϊ�Է�ѹ��ʾ��ƽ�ⳣ��)��
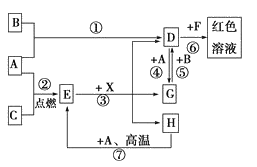
(3)�ü����![]() ���ɵ�ȼ�ϵ�ص��
���ɵ�ȼ�ϵ�ص��![]() ��Һ��װ������ͼ��ʾ����Ӧ��ʼ�۲쵽x�缫�������ְ�ɫ��������A��ͨ���������
��Һ��װ������ͼ��ʾ����Ӧ��ʼ�۲쵽x�缫�������ְ�ɫ��������A��ͨ���������
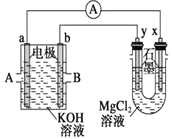
���𰸡��� ȱ��![]()
![]() > >0
> >0 ![]() 25%
25% ![]()
![]()
![]()
��������
��1��ȼ������ָ1mol��������ȫȼ�������ȶ���������ʱ���ͷŵ�������
��2������![]() ��֪���÷�ӦΪ��Ӧǰ������������ı�ķ�Ӧ��ѹǿ����ƽ�������ƶ���
��֪���÷�ӦΪ��Ӧǰ������������ı�ķ�Ӧ��ѹǿ����ƽ�������ƶ���![]() ���������������ͼ�еĺ����������������ɵã������¶ȵ����ߣ�
���������������ͼ�еĺ����������������ɵã������¶ȵ����ߣ�![]() �����������С�����¶����ߣ�ƽ�������ƶ���
�����������С�����¶����ߣ�ƽ�������ƶ���
�ڻ�ѧƽ�ⳣ��ֻ���¶��йأ��÷�Ӧ������ӦΪ���ȷ�Ӧ�������¶����ߣ���ѧƽ�ⳣ������
��q��![]() ���������Ϊ
���������Ϊ![]() ����ʼͨ��
����ʼͨ��![]()
![]() ��
��![]() ����������ʽ��
����������ʽ��
![]()
ʼ̬![]()
ת��![]()
q��![]()
���㼴�ɣ�
��3����Ӧ��ʼ�۲쵽x�缫�������ְ�ɫ������˵��x�缫�����������������ӣ���x�������������ӷŵ�����������y�������������ӷŵ�����������x��ԭ��صĸ���������y��ԭ��ص�������������a�Ǹ�����b���������ݴ˷������
��1��ȼ������ָ1mol��������ȫȼ�������ȶ���������ʱ���ͷŵ��������ɷ�Ӧ![]() ��֪��ˮΪ��̬�����Բ�����
��֪��ˮΪ��̬�����Բ�����![]() ��
��![]() ��
��![]() ��ȼ���ȼ�����÷�Ӧ��
��ȼ���ȼ�����÷�Ӧ��![]() ��ȱ��
��ȱ��![]()
![]() ���ʴ�Ϊ����ȱ��
���ʴ�Ϊ����ȱ��![]()
![]() ��
��
��2������![]() ��֪���÷�ӦΪ��Ӧǰ������������ı�ķ�Ӧ��ѹǿ����ƽ�������ƶ���
��֪���÷�ӦΪ��Ӧǰ������������ı�ķ�Ӧ��ѹǿ����ƽ�������ƶ���![]() �������������ͼ��P1ʱ��
�������������ͼ��P1ʱ��![]() �������������P2ʱ��
�������������P2ʱ��![]() ���������������P1> P2����ͼ�еĺ����������������ɵã������¶ȵ����ߣ�
���������������P1> P2����ͼ�еĺ����������������ɵã������¶ȵ����ߣ�![]() �����������С�����¶����ߣ�ƽ�������ƶ������Ը÷�Ӧ������ӦΪ���ȷ�Ӧ��
�����������С�����¶����ߣ�ƽ�������ƶ������Ը÷�Ӧ������ӦΪ���ȷ�Ӧ��![]() >0���ʴ�Ϊ��>��>0��
>0���ʴ�Ϊ��>��>0��
�ڻ�ѧƽ�ⳣ��ֻ���¶��йأ��÷�Ӧ������ӦΪ���ȷ�Ӧ�������¶����ߣ���ѧƽ�ⳣ�������¶ȴ�С��ϵΪ��![]() ������m��n��q����Ļ�ѧƽ�ⳣ����С��ϵΪ��
������m��n��q����Ļ�ѧƽ�ⳣ����С��ϵΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��q��![]() ���������Ϊ
���������Ϊ![]() ����ʼͨ��
����ʼͨ��![]()
![]() ��
��![]() ����������ʽ��
����������ʽ��
![]()
ʼ̬![]()
ת��![]()
q��![]()
��![]() ������q������ת����Ϊ��
������q������ת����Ϊ��![]() ���������µĻ�ѧƽ�ⳣ��
���������µĻ�ѧƽ�ⳣ��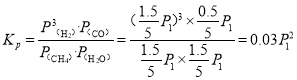 ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��
��3����Ӧ��ʼ�۲쵽x�缫�������ְ�ɫ��������������������þ�İ�ɫ��������ӦʽΪ��![]() ����x�缫Ϊ������aΪ�����������
����x�缫Ϊ������aΪ�����������![]() ���ɵ�ȼ�ϵ���У�����������������������������A��ͨ���������
���ɵ�ȼ�ϵ���У�����������������������������A��ͨ���������![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��

 һ����ʦ�����Ծ�ϵ�д�
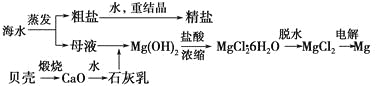
һ����ʦ�����Ծ�ϵ�д�����Ŀ�����ǵؿ��к�����21�ḻԪ�أ�������������Ԫ�أ����������Ͱ�֢��������Ѫ�ܵȾ���DZ�ڵ�ҩ��ѧ���á���ҵ���ú����۷�![]() Ϊ����ijʯúΪԭ��(����
Ϊ����ijʯúΪԭ��(����![]() ��CaO������)���ƻ��������Ʊ�
��CaO������)���ƻ��������Ʊ�![]() �����������£�
�����������£�
![]()
��֪��+5�۷�����Һ�е���Ҫ������ʽ����ҺpH�Ĺ�ϵ���±���
pH | 4~6 | 6~8 | 8~10 | 10~12 |
��Ҫ���� |
|
|
|
|
(1)���գ���ʯú�м���ʯ�ұ��գ���![]() ת��Ϊ
ת��Ϊ![]() �Ļ�ѧ����ʽ��________________��
�Ļ�ѧ����ʽ��________________��
(2)�����![]() ������ˮ�����������ᡣ����ɰ���ʱ��Һ��
������ˮ�����������ᡣ����ɰ���ʱ��Һ��![]() ��
��![]() ������������ӷ���ʽ��________________��
������������ӷ���ʽ��________________��
(3)ת����������Һ�еķ�ת��Ϊ![]() ���壬���������£�
���壬���������£�
![]()
�ٽ���Һ�м���ʯ�����������____________________________________��
����![]() ��Һ�м���
��Һ�м���![]() ��Һ��������Һ��
��Һ��������Һ��![]() ����
����![]() ʱ��
ʱ��![]() �IJ������Խ��ͣ�ԭ����_______________________________________��
�IJ������Խ��ͣ�ԭ����_______________________________________��
(4)ʵ������![]() Ϊԭ�ϻ����Ժϳ������Ʊ�
Ϊԭ�ϻ����Ժϳ������Ʊ�![]() ������(IV)��ʽ̼��茶��壬�������£�
������(IV)��ʽ̼��茶��壬�������£�
![]()
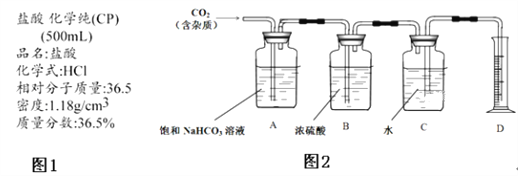
�ٲ�����������ͼװ��(����������)�н��С���֪��![]() �ܱ�
�ܱ�![]() ������
������
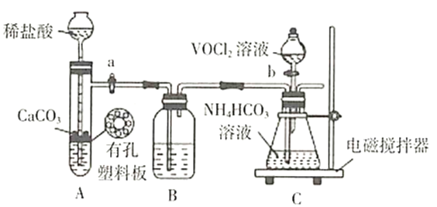
ҩƷ��װ��ɺ��ʵ�������________(��������a����������b���IJ���˳��)��װ��B�е��Լ���________��
�ڲⶨ����(IV)��ʽ̼��茶���ֲ�Ʒ�з��ĺ�����
����4.246g��Ʒ����ƿ�У���20mL����ˮ��30mL�������ܽ��![]() ��
��![]() ��Һ���Թ�������ַ�Ӧ�������1%
��Һ���Թ�������ַ�Ӧ�������1%![]() ��Һ���Թ������������س�ȥ������
��Һ���Թ������������س�ȥ������![]() �������
�������![]() ��
��![]() ����Һ�ζ����յ㣬�������Ϊ30.00mL(�ζ���Ӧ��
����Һ�ζ����յ㣬�������Ϊ30.00mL(�ζ���Ӧ��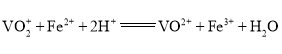 )��
)��
![]() ��Һ��������________________���ֲ�Ʒ�з�����������Ϊ________________(��ȷ��С�������λ)��
��Һ��������________________���ֲ�Ʒ�з�����������Ϊ________________(��ȷ��С�������λ)��