题目内容
【题目】中国科学家创造性地构建了硅化物晶格限域的单铁中心催化剂,成功地实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、芳烃和氢气等化学品。请回答下列问题:
(1)基态铁原子的价层电子轨道表达式为______。
(2)硅、碳位于同一主族,用“![]() ”“
”“![]() ”或“
”或“![]() ”填空:
”填空:
性质 | 原子半径 | 第一电离能 | 熔点 | 键能 |
项目 |
|
|
|
|
(3)CN-能与Fe3+形成配合物,与CN-互为等电子体的分子有______ (任写一种);1 mol[Fe(CN)6 ]3-中含______molσ键。
(4)已知:反应![]() ,碳原子的杂化类型转化过程为______;
,碳原子的杂化类型转化过程为______;
从共价键重叠方式看,![]() 分子中
分子中![]() 键类型为;
键类型为;![]() 的键角比
的键角比![]() 的键角______
的键角______![]() 填“大”或“小”
填“大”或“小”![]() 。
。
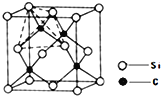
(5)晶体有两种晶胞,如图1、图2所示。

图1中晶胞中铁的配位数为______;图2中铁晶胞堆积方式为______。
(6)碳化硅晶胞如图3所示,已知碳化硅晶体的密度为dgcm-3,NA表示阿伏加德罗常数的值,则碳化硅中硅碳键的键长为______ pm。
【答案】![]()
![]()
![]()
![]()
![]()
![]() 或CO 12
或CO 12 ![]() 杂化转化为
杂化转化为![]() 杂化 小
杂化 小 ![]() 面心立方最密堆积
面心立方最密堆积 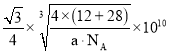
【解析】
(1)根据铁原子的价层电子排布式、泡利原理和洪特规则即可画出轨道表达式;
(2)同主族自上而下原子半径逐渐增大,第一电离能逐渐减小;原子晶体的熔沸点大于分子晶体;键长越短,键能越大,据此分析作答;
(3)等电子体可采用替换法进行解答;配位键也属于![]() 键,
键,![]() 中
中![]() 与
与![]() 形成6个配位键,即6个
形成6个配位键,即6个![]() 键,而
键,而![]() 中有1个
中有1个![]() 键,一共有6个
键,一共有6个![]() ,据此可算出
,据此可算出![]() 键的总键数;
键的总键数;
(4)CH4为正四面体结构,C原子采取![]() 杂化,键角为
杂化,键角为![]() ,
,![]() 为平面结构,C原子采取
为平面结构,C原子采取![]() 杂化,键角为
杂化,键角为![]() ,
,![]() 分子中1s与1s电子云重叠形成
分子中1s与1s电子云重叠形成![]() 键, 据此分析作答;
键, 据此分析作答;
(5)图1属于体心立方堆积,Fe原子配位数为8
(6)C原子与周围4个Si原子形成正四面体结构,碳化硅晶体内碳硅键的键长即为晶胞顶点Si原子与正四面体中心C原子之间的距离,二者连线处于晶胞体对角线上,距离等于晶胞体对角线长度的![]() ,而晶胞体对角线长度等于晶胞棱长的
,而晶胞体对角线长度等于晶胞棱长的![]() 倍,晶胞中C原子数目
倍,晶胞中C原子数目![]() 、Si原子数目
、Si原子数目![]() ,晶胞质量
,晶胞质量![]() ,根据晶胞的质量和密度可计算出晶胞的体积和晶胞的棱长,进而算出碳化硅晶体内碳硅键的键长,据此分析解答;
,根据晶胞的质量和密度可计算出晶胞的体积和晶胞的棱长,进而算出碳化硅晶体内碳硅键的键长,据此分析解答;
(1)基态铁原子的价层电子排布式为![]() ,由泡利原理、洪特规则,轨道表达式为:
,由泡利原理、洪特规则,轨道表达式为:![]() ;
;
故答案为:![]() ;
;
(2)①同主族自上而下原子半径增大,故原子半径:![]() ;
;
故答案为:![]() ;
;
②同主族自上而下第一电离能减小,故第一电离能:![]() ;
;
故答案为:![]() ;
;
③CO2属于分子晶体,而![]() 属于原子晶体,故熔点:
属于原子晶体,故熔点:![]() ;
;
故答案为:![]() ;
;
④C-H的键长比![]() 键的短,故键能:
键的短,故键能:![]() ;
;
故答案为:![]() ;
;
![]() 用N原子替换C原子与1个单位负电荷,或者用O原子替换N原子与1个单位负电荷,得到与
用N原子替换C原子与1个单位负电荷,或者用O原子替换N原子与1个单位负电荷,得到与![]() 互为等电子体的分子为:
互为等电子体的分子为:![]() 或CO;
或CO;![]() 中
中![]() 与
与![]() 形成6个配位键,
形成6个配位键,![]() 中有span>1个
中有span>1个![]() 键,故
键,故![]() 中共有12个
中共有12个![]() 键,1
键,1![]() 中含
中含![]() 键;
键;
故答案为:![]() 或CO;12;
或CO;12;
![]() 为正四面体结构,C原子采取
为正四面体结构,C原子采取![]() 杂化,
杂化,![]() 为平面结构,C原子采取
为平面结构,C原子采取![]() 杂化,碳原子的杂化类型转化过程为:
杂化,碳原子的杂化类型转化过程为:![]() 杂化转化为
杂化转化为![]() 杂化;
杂化;![]() 分子中1s与1s电子云重叠形成
分子中1s与1s电子云重叠形成![]() 键,从共价键重叠方式看,
键,从共价键重叠方式看,![]() 分子中
分子中![]() 键类型为
键类型为![]() 键;甲烷分子中键角为
键;甲烷分子中键角为![]() ,乙烯中键角约是
,乙烯中键角约是![]() ,
,![]() 的键角比
的键角比![]() 的键角小;
的键角小;
故答案为:![]() 杂化转化为
杂化转化为![]() 杂化;
杂化;![]() 键;小;
键;小;
![]() 图1中体心Fe原子与位于顶点的Fe原子相邻,Fe原子配位数为8;图2中Fe原子处于面心、顶点,属于面心立方最密堆积;
图1中体心Fe原子与位于顶点的Fe原子相邻,Fe原子配位数为8;图2中Fe原子处于面心、顶点,属于面心立方最密堆积;
故答案为:8;面心立方最密堆积;
![]() 原子与周围4个Si原子形成正四面体结构,碳化硅晶体内碳硅键的键长即为晶胞顶点Si原子与正四面体中心C原子之间的距离,二者连线于晶胞体对角线上,距离等于晶胞体对角线长度的
原子与周围4个Si原子形成正四面体结构,碳化硅晶体内碳硅键的键长即为晶胞顶点Si原子与正四面体中心C原子之间的距离,二者连线于晶胞体对角线上,距离等于晶胞体对角线长度的![]() ,而晶胞体对角线长度等于晶胞棱长的
,而晶胞体对角线长度等于晶胞棱长的![]() 倍,晶胞中C原子数目
倍,晶胞中C原子数目![]() ,Si原子数目
,Si原子数目![]() ,晶胞质量
,晶胞质量![]() ,晶胞体积
,晶胞体积![]()
![]()
![]() ,晶胞棱长
,晶胞棱长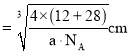 ,故碳化硅晶体内碳硅键的键长
,故碳化硅晶体内碳硅键的键长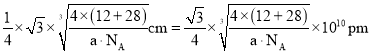 ;
;
故答案为: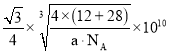 ;
;

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案