题目内容
10.如图是一个电化学过程的示意图,请回答下列问题:
(1)图中甲池是原电池 (填“原电池”“电解池”或“电镀池”).
(2)A(石墨)电极的名称是阳极 (填“正极”“负极”“阴极”或“阳极”)
(3)写出通入CH3OH的电极的电极反应式CH3OH-6e-+8OH-═6H2O+CO32-
(4)乙池中反应的化学方程式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3
(5)当乙池中B(Ag)极质量增加54g,甲池中理论上消耗O2的体积为2.8L(标况).若丙槽为饱和食盐水,最终剩余液体为400mL,则电解后得到碱液的物质的量浓度为1.25mol/L.
分析 (1)图中甲池能自发进行氧化还原反应,属于原电池;
(2)通入甲醇的电极为负极、通入氧气的电极为正极,电解池中连接原电池负极的电极为阴极、连接原电池正极的电极为阳极;
(3)甲醇失电子和氢氧根离子反应生成碳酸根离子和水;
(4)乙池中A电极上氢氧根离子放电、阴极上银离子放电;
(5)根据转移电子相等计算消耗氧气体积和反应后溶液浓度.
解答 解:(1)图中甲池能自发进行氧化还原反应,将化学能转化为电能,所以属于原电池,故答案为:原电池;
(2)通入甲醇的电极为负极、通入氧气的电极为正极,A连接原电池正极,为电解池阳极,故答案为:阳极;
(3)甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH-6e-+8OH-═6H2O+CO32-,故答案为:CH3OH-6e-+8OH-═6H2O+CO32-;
(4)乙池中A电极上氢氧根离子放电、阴极上银离子放电,所以乙池电池反应式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3,故答案为:4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3;
(5)B(Ag)极的质量增加54g时,n(Ag)=$\frac{54g}{108g/mol}$=0.5mol,则转移电子为0.5mol,根据转移电子相等,则消耗氧气体积=$\frac{0.5mol}{4}$=2.8L,
用惰性电极电极食盐水的电解方程式为,2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,每转移2mol电子生成2molNaOH,现在转移0.5mol电子,生成0.5molNaOH,则电解后得到碱液的物质的量浓度为$\frac{0.5mol}{0.4L}$=1.25mol/L,
故答案为:2.8;1.25mol/L.
点评 本题考查了原电池和电解池原理,涉及电极反应式的书写及物质的量的金属,会结合电解质溶液酸碱性书写电极反应式,再结合转移电子相等进行计算,题目难度不大.

 学业测评一课一测系列答案
学业测评一课一测系列答案| A. | HF | B. | HCl | C. | HBr | D. | HI |
| A. | 用于青奥村工程隔热保温材料聚氨酯属于有机高分子材料 | |
| B. | 青奥会议中心双塔采用了玻璃幕墙设计,制造玻璃的主要原料为纯碱和石灰石 | |
| C. | 青奥中心外墙的复合保温材料采用铝合金锁边,铝合金比金属铝更具有强度大、耐腐蚀的优点 | |
| D. | 青奥会健身中心的地面采用了聚苯乙烯保温板,聚苯乙烯的结构简式为 |
| A. | “钡餐”中使用的硫酸钡是弱电解质 | |
| B. | 太阳能电池板中的硅在周期表中处于金属与非金属的交界位置 | |
| C. | 常用的自来水消毒剂有Cl2和二氧化氯,两者都含极性键 | |
| D. | “滴水穿石”不涉及化学变化 |
| A. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| B. | NH4Cl的电子式: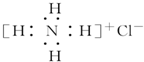 | |
| C. | H、D、T互为同素异形体 | |
| D. | Cl的原子结构示意图: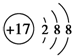 |
| A. | 豆浆 | B. | NaCl溶液 | C. | HCl | D. | 空气 |
| A. | 某烃的分子式为 C10H14,它不能使溴水因反应而褪色,但可使酸性 KMnO4 溶液褪色,且分子结构中只有一个烷基,符合条件的芳香烃有 4 种(已知: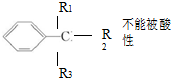 KMnO44氧化) KMnO44氧化) | |
| B. | 2,4-二甲基-3,3-二乙基戊烷的一氯代物有4种 | |
| C. | 甲烷与氯气的混合气体在光照条件下反应生成的有机化合物均无同分异构体 | |
| D. | 乙烷与丙烯的物质的量共 1mol,完全燃烧生成 3molH2O |
 将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)
将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)