题目内容
15.已知实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.现将17.4g MnO2投入到400g质量分数为36.5%的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:(1)标准状况下生成Cl2的体积为多少?(2)剩余HCl的物质的量为多少?
分析 根据n=$\frac{m}{M}$计算二氧化锰物质的量,再根据方程式计算生成氯气、和消耗盐酸的物质的量,根据V=nVm计算氯气的体积,结合盐酸的总量和反应消耗盐酸的量来求剩余HCl的物质的量.
解答 解:17.4gMnO2的物质的量=$\frac{17.4g}{87g/mol}$=0.2mol,
MnO2 +4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2 +Cl2↑+2H2O
1 4 1
0.2mol n(HCl) n(Cl2)
n(HCl)=0.2mol×4=0.8mol
n(Cl2)=0.2mol
故标况下,生成氯气得到体积=0.2mol×22.4L/mol=4.48L,剩余HCl的物质的量为:$\frac{400g×36.5%}{36.5g/mol}$-0.8mol=3.2mol.
答:(1)标准状况下生成Cl2的体积为4.48L;
(2)剩余HCl的物质的量为3.2mol.
点评 本题考查化学方程式有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
3.硫酸钡不容易被X射线透过,在医疗上可作检查肠胃的内服药剂.硫酸钡属于( )
| A. | 酸 | B. | 混合物 | C. | 氧化物 | D. | 盐 |
10.区别溶液和胶体最简单的方法是( )
| A. | 丁达尔现象 | B. | 闻气味 | ||
| C. | 过滤 | D. | 根据分散质微粒直径 |
7.下列关于${\;}_{49}^{115}$In的说法中,错误的是( )
| A. | ${\;}_{49}^{115}$In原子核外有49个电子 | |
| B. | ${\;}_{49}^{115}$In是In元素的一种核素 | |
| C. | ${\;}_{49}^{115}$In原子核内质子数和中子数之差等于17 | |
| D. | ${\;}_{49}^{115}$In原子核内有49个中子 |

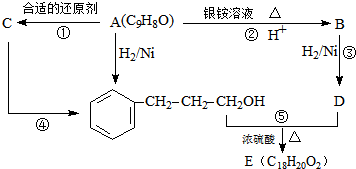
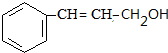 .
.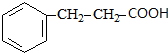 +
+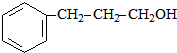 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$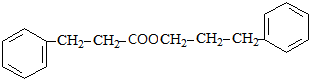 +H2O.
+H2O.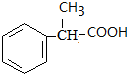 .
.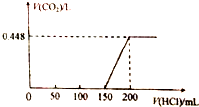 将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)
将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)