题目内容
【题目】(1)3.01×1023个氯气分子的物质的量是________,氯原子的物质的量是________。
(2)1.5mol Na2SO4·10H2O中所含的Na+的物质的量是________,所含的SO42-的物质的量是________,所含H2O的数目是______。
(3)一定量的Na2CO3中,碳原子和氧原子的物质的量之比为______。
(4)0.5mol NaOH中含有电子的物质的量是__________,在________mol Na2CO3中所含Na+数目与上述0.5mol NaOH所含Na+数目相等。
(5)12.4g Na2R含0.4mol Na+,则Na2R的摩尔质量为_______,R的相对原子质量为________。含R的质量为1.6g的Na2R,其物质的量为_______。
【答案】0.5mol 1mol 3mol 1.5mol 9.03×1024或15NA 1∶3 10mol 0.25 62g·mol-1 16 0.1mol
【解析】
(1)3.01×1023个氯气分子的物质的量是![]() =0.5mol,氯原子的物质的量是0.5mol×2=1mol;
=0.5mol,氯原子的物质的量是0.5mol×2=1mol;
(2)1.5 mol Na2SO4·10H2O中所含的Na+的物质的量是1.5 mol×2=3mol;所含的SO42-的物质的量是1.5 mol×1=1.5mol;所含H2O的数目是1.5 mol×10×6.02×1023mol-1=9.03×1024个,或15NA个;
(3)一定量的Na2CO3中,碳原子和氧原子的数目比为1∶3,则碳原子和氧原子的物质的量之比为1∶3;
(4)每个中含有20个电子,0.5 mol NaOH中含有电子的物质的量是0.5mol×20=10mol;0.5mol NaOH所含Na+的物质的量为0.5mol,则Na2CO3的物质的量为0.5mol÷2=0.25mol;
(5)12.4g Na2R含0.4 mol Na+,则Na2R的物质的量为0.4mol÷2=0.2mol,摩尔质量为12.4g÷0.2mol=62g·mol-1,Na2R的相对分子质量为62,R的相对原子质量为62-23×2=16;1.6g的R物质的量为![]() =0.1mol,含R的质量为1.6 g的Na2R,其物质的量为0.1mol。
=0.1mol,含R的质量为1.6 g的Na2R,其物质的量为0.1mol。

【题目】研究化学反应时,既要考虑物质变化与能量变化,又要关注反应的快慢与限度。回答下列问题:
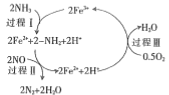
(1)NH3还原NO是重要的烟气脱硝技术,其反应过程与能量关系如下图所示。

①上图中因为改变了反应条件,反应的活化能b___________(填“>”“<”或“=”)a。
②脱硝反应的热化学方程式可表示为反应物→生成物△H=___________(用E1, E2的代数式表示)
③研究发现,一定条件下的脱硝反应过程可能如图所示,根据氧化还原反应中物质的作用,NO为剂____,脱硝总反应的化学方程式为:___________。
(2)一定温度下,将不同物质的量的H2O(g)和CO分别通入容积为1L的恒容密闭容器中,进行反应H2O(g)+CO(g)=CO2(g)+H2(g),得到如表所示的三组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O(g) | CO(g) | CO(g) | H2(g) | |||
1 | 650 | 2.0 | 4.0 | 3.0 | 1.0 | 5 |
2 | 900 | 1.0 | 2.0 | 1.8 | 0.2 | 4 |
3 | 900 | a | b | c | d | t |
①实验2:4min
②650℃时,若在此容器中充入2.0molH2O(g)、1.0molCO(g)、1.0molCO2(g)和xmolH2(g),要使反应在开始时间向正反应方向进行,则x应满足的条件是___________。
③若a=2.0,b=1.0,则平衡时实验2中H2O(g)和实验3中CO(g)的转化率(α)的关系为α(H2O)___________(填“>”“<”或“=”)α(CO)。