题目内容
【题目】脱除烟气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)以漂粉精溶液为吸收剂脱除烟气中的NO,相关热化学方程式如下:
ⅰ.4NO(g) + 3O2(g) + 2H2O(l) = 4HNO3(aq) H1 =﹣423 kJ·mol-1
ⅱ.Ca(ClO)2(aq) = CaCl2(aq) + O2(g) H2 =﹣120 kJ·mol-1
ⅲ.3Ca(ClO)2(aq) + 4NO(g) + 2H2O(l) = 4HNO3(aq) + 3CaCl2(aq) H3
① H3 = _______kJ·mol-1 。
② 反应ⅲ的平衡常数随温度升高的变化趋势是________。
(2)HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。C12和Ca(OH)2制取漂粉精的化学方程式是________。
(3)次氯酸盐脱除NO的主要过程如下:
a.NO+HClO = NO2+HCl
b.NO + NO2+H2O 2HNO2
c.HClO+ HNO2 = HNO3+HCl
下列分析正确的是________。
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
(4)研究不同pH、不同温度下漂粉精溶液对NO脱除率的影响,结果如图1、图2。
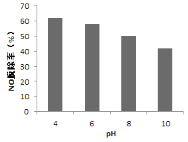

图1 图2
① 图1中,pH降低NO脱除率增大的原因:________。
② 脱除过程中往往有Cl2产生,原因是________(用离子方程式表示)。
③ 图2中,60~80℃ NO脱除率下降的原因:________。(至少答出两点)
【答案】-783.kJ/mol 变小 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O AC pH降低,ClO- + H+ = HClO,溶液中c(HClO)增大 HClO + Cl- + H+ = Cl2↑+ H2O(或ClO-+Cl-+2H+=Cl2↑+H2O) HClO受热分解,c(HClO)浓度减小,气体溶解度降低;反应b平衡逆向移动;反应ⅲ平衡逆向移动等
【解析】
(1)反应ⅲ=ⅰ+3×ⅱ;ΔH3=ΔH1+3×ΔH2=﹣423 kJ·mol-1+3×(﹣120 kJ·mol-1)=-783.kJ/mol;反应ⅲ为放热反应,升高温度,平衡逆向移动,化学平衡常数减小;答案为-783.kJ/mol 变小;
(2)氯气和Ca(OH)2反应,生成CaCl2和Ca(ClO)2,为歧化反应,答案为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)A.烟气中含有的少量O2,可直接与NO作用生成NO2,可以直接发生反应b,可以提高NO的脱除率,A项正确;B.NO2可以直接与水反应,生成NO和HNO3,有NO,可以发生脱除反应,此外NO2化合价可以升高,具有还原性,HClO具有氧化性,也可以反应。B项错误;C.脱除过程中,HClO为弱酸,但是生成了硝酸和盐酸两种强酸,pH值会减小,C项正确,答案为AC;
(4)①由于HClO是弱酸,会电离,HClO![]() ClO-+H+,pH减小,电离平衡逆向移动,HClO的浓度变大,有利于反应a和b的进行,答案为pH降低,ClO- + H+ = HClO,溶液中c(HClO)增大;
ClO-+H+,pH减小,电离平衡逆向移动,HClO的浓度变大,有利于反应a和b的进行,答案为pH降低,ClO- + H+ = HClO,溶液中c(HClO)增大;
②有氯气生成,联想到84消毒液和洁厕灵不能混合使用,溶液中既有Cl-又有HClO可以发生归中反应,生成Cl2,答案为HClO + Cl- + H+ = Cl2↑+ H2O(或ClO-+Cl-+2H+=Cl2↑+H2O);
③60~80℃较之前温度有所提高,可以从物质分解、气体溶解度和平衡移动的角度思考,HClO不稳定,易分解,升高温度使HClO分解,溶液中的HClO浓度降低,NO脱除率降低。气体的溶解度随着温度的升高而降低,NO的脱除率降低;反应b为化合反应,绝大多数化合为放热反应,升高温度反应b逆向移动,反应ⅲ也放热反应,也逆向移动;均会使NO脱除率降低。答案为HClO受热分解,c(HClO)浓度减小,气体溶解度降低;反应b平衡逆向移动;反应ⅲ平衡逆向移动等。

【题目】某研究小组为了验证反应物浓度对反应速率的影响,选用硫酸酸化的高锰酸钾溶液与草酸H2C2O4溶液在室温下进行反应。实验中所用的草酸为稀溶液,视为强酸。
(1)写出硫酸酸化的高锰酸钾氧化稀草酸溶液的离子方程式__________。
(2)该小组进行了实验I,数据如下。
H2SO4溶液 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.1mol/L | 2:03 |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
一般来说,其他条件相同时,增大反应物浓度,反应速率___________(填“增大”或“减小”)。但分析该实验数据,得到的结论是在当前实验条件下,增大草酸浓度,反应速率减小。
(3)该小组欲探究出现上述异常现象的原因,在实验I的基础上,只改变草酸溶液浓度进行了实验II,获得实验数据并绘制曲线图如下。

该小组查阅资料获取如下信息,其中能够解释MO变化趋势的是___________。
a | KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II)。(括号中罗马数字表示锰的化合价) |
b | 草酸根易与不同价态锰离子形成较稳定的配位化合物。 |
c | 草酸稳定性较差,加热至185℃可分解。 |
(4)该小组为探究ON段曲线变化趋势的原因,又进行了实验III,所得数据如下。
H2SO4溶液 | Na2SO4固体 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 0.1mol/L | 1.9×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 16:20 |
1mL 0.5mol/L | 1.5×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 8:25 |
1mL 1.0mol/L | 1.0×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 6:15 |
1mL 2.0mol/L | 0 | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
该小组进行实验III的目的是____________________________________________。
(5)综合实验I、II、III,推测造成曲线MN变化趋势的原因________________。
a.当草酸浓度较小时,C2O42-起主要作用,草酸浓度越大,反应速率越小
b.当草酸浓度较小时,H+起主要作用,草酸浓度越大,反应速率越大
c.当草酸浓度较大时,C2O42-起主要作用,草酸浓度越大,反应速率越小
d.当草酸浓度较大时,H+起主要作用,草酸浓度越大,反应速率越大
【题目】探究铝片与Na2CO3溶液的反应。
| | |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
下列说法不正确的是
A. Na2CO3溶液中存在水解平衡:CO32- + H2O HCO3- + OH-
B. 对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
C. 推测出现白色浑浊的原因:AlO2- + HCO3- + H2O = Al(OH)3↓+ CO32-
D. 加热和H2逸出对CO32- 水解平衡移动方向的影响是相反的