题目内容
【题目】研究化学反应时,既要考虑物质变化与能量变化,又要关注反应的快慢与限度。回答下列问题:
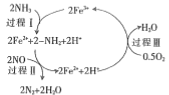
(1)NH3还原NO是重要的烟气脱硝技术,其反应过程与能量关系如下图所示。

①上图中因为改变了反应条件,反应的活化能b___________(填“>”“<”或“=”)a。
②脱硝反应的热化学方程式可表示为反应物→生成物△H=___________(用E1, E2的代数式表示)
③研究发现,一定条件下的脱硝反应过程可能如图所示,根据氧化还原反应中物质的作用,NO为剂____,脱硝总反应的化学方程式为:___________。
(2)一定温度下,将不同物质的量的H2O(g)和CO分别通入容积为1L的恒容密闭容器中,进行反应H2O(g)+CO(g)=CO2(g)+H2(g),得到如表所示的三组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O(g) | CO(g) | CO(g) | H2(g) | |||
1 | 650 | 2.0 | 4.0 | 3.0 | 1.0 | 5 |
2 | 900 | 1.0 | 2.0 | 1.8 | 0.2 | 4 |
3 | 900 | a | b | c | d | t |
①实验2:4min
②650℃时,若在此容器中充入2.0molH2O(g)、1.0molCO(g)、1.0molCO2(g)和xmolH2(g),要使反应在开始时间向正反应方向进行,则x应满足的条件是___________。
③若a=2.0,b=1.0,则平衡时实验2中H2O(g)和实验3中CO(g)的转化率(α)的关系为α(H2O)___________(填“>”“<”或“=”)α(CO)。
【答案】< -(E2-E1) 还原剂 4NH3+4NO+O2![]() 4N2+6H2O 0.05mol/L-1·min-1
4N2+6H2O 0.05mol/L-1·min-1 ![]() 增大 0≤x<
增大 0≤x<![]() =
=
【解析】
(1)①由图像可知活化能降低;
②由图像可知,反应物能量大于生成物能量,故反应是放热反应,用-表示放热,△H=生成物能量-反应物能量;
③NO在反应中化合价降低,作还原剂;由图2可知反应物为NH3,NO和O2生成物为N2和H2O;
(2)①三行式法计算; 计算实验1和实验2的平衡常数,通过比较K判断正反应放热还是吸热;
②计算Qc,利用Q和K之间关系确定范围;
③根据平衡常数和三段式分别求出实验2中H2O(g)的转化率为20%实验3中CO(g)的转化率为20%;
(1)①由图像可知活化能降低,b<a;
答案:<
②由图像可知,反应物能量大于生成物能量,故反应是放热反应,用-表示放热,△H=生成物能量-反应物能量;
答案:-(E2-E1)
③NO在反应中化合价降低,作还原剂;由图2可知反应物为NH3,NO和O2生成物为N2和H2O,所以化学方程式为4NH3+4NO+O2![]() 4N2+6H2O;
4N2+6H2O;
答案:还原剂,4NH3+4NO+O2![]() 4N2+6H2O
4N2+6H2O
(2)①实验2:900℃ 实验1:650℃
H2O(g)+CO(g)=CO2(g)+H2(g) H2O(g)+CO(g)=CO2(g)+H2(g)
C初 1.0 2.0 0 0 C初 2.0 4.0 0 0
△C 0.2 0.2 0.2 0.2 △C 1.0 1.0 1.0 1.0
C平 0.8 1.8 0.2 0.2 C平 1.0 3.0 1.0 1.0
k(900℃)=![]() =
=![]() k(650℃)=
k(650℃)=![]() =
=![]()
v(CO2)=![]() =
=![]() =0.05mol/L-1·min-1
=0.05mol/L-1·min-1
根据平衡常数计算公式,900℃平衡常数为![]() ,650℃平衡常数为
,650℃平衡常数为![]() ,故降低温度平衡常数增大;答案:0.05mol/L-1·min-1;
,故降低温度平衡常数增大;答案:0.05mol/L-1·min-1;![]() ;增大
;增大
②H2O(g)+CO(g)=CO2(g)+H
C 2.0 1.0 1.0 x
Qc=![]() =
=![]()
计算此时此刻的Qc=![]() ,化学平衡正向移动,所以Qc<平衡常数k,所以
,化学平衡正向移动,所以Qc<平衡常数k,所以![]() ,
,![]() ;
;
答案:0≤x<![]()
③①实验2:900℃ 实验1:650℃
H2O(g)+CO(g)=CO2(g)+H2(g) H2O(g)+CO(g)=CO2(g)+H2(g)
C初 1.0 2.0 0 0 C初 2.0 1.0 0 0
△C 0.2 0.2 0.2 0.2 △C x x x x
C平 0.8 1.8 0.2 0.2 C平 2.0-x 1.0-x x x
H2O(g)的转化率=![]() ×100%=20% k(900℃)=
×100%=20% k(900℃)=![]() =
=![]() x=0.2
x=0.2
CO(g)的转化率=![]() ×100%=20%
×100%=20%
根据平衡常数和三段式分别求出实验2中H2O(g)的转化率为20%实验3中CO(g)的转化率为20%;
答案:=

【题目】探究铝片与Na2CO3溶液的反应。
| | |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
下列说法不正确的是
A. Na2CO3溶液中存在水解平衡:CO32- + H2O HCO3- + OH-
B. 对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
C. 推测出现白色浑浊的原因:AlO2- + HCO3- + H2O = Al(OH)3↓+ CO32-
D. 加热和H2逸出对CO32- 水解平衡移动方向的影响是相反的