题目内容
【题目】a、b、c、d为四种由短周期元素构成的中性粒子,它们都有14个电子,且都是共价形分子。回答下列问题:
(1)a是单核分子,a单质可用作半导体材料,a原子核外电子排布式为____________________。
(2)b是双核化合物,常温下为无色无味气体。b的化学式为________。人一旦吸入b气体后,就易引起中毒,是因为_______________________________________________而中毒。
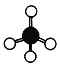
(3)c是双核单质,写出其电子式____________________________________________。c分子中所含共价键的类型为____________(填“极性键”或“非极性键”)。c单质常温下性质稳定,不易起反应,原因是______________________________________________。
(4)d是四核化合物,其结构式为____________________________________________;d分子内所含共价键有________个σ键,________个π键;σ键与π键的强度大小关系为σ______π(填“>”、“<”或“=”),原因是___________________________。
【答案】1s22s22p63s23p2 CO CO一旦被吸入肺里后,会与血液中的血红蛋白结合,使血红蛋白丧失输送氧气的能力 ![]() 非极性键 N2分子中的共价三键键能很大,共价键很牢固 H—C≡C—H 3 2 > 形成σ键的原子轨道的重叠程度比π键的重叠程度大,形成的共价键强
非极性键 N2分子中的共价三键键能很大,共价键很牢固 H—C≡C—H 3 2 > 形成σ键的原子轨道的重叠程度比π键的重叠程度大,形成的共价键强
【解析】
由题意知,a是单原子分子,含14个电子,是Si,Si可作半导体材料;b是两个原子的化合物,根据其物理性质:无色无味气体,推断b为CO,CO一旦进入肺里,会与血液中的血红蛋白结合而使血红蛋白丧失输送氧气的能力,使人中毒;c是双原子单质,每个原子有7个电子,故c为N2,N2分子的结构式为N≡N,为非极性键,N2分子中的共价三键键能很大,所以N2分子很稳定;d是四核化合物,即4个原子共有14个电子,只能是烃,故d为C2H2,C2H2的结构式为H—C≡C—H,有两个H—C σ键,一个C—C σ键,两个π键,据以上分析解答。
由题意知,a是单原子分子,含14个电子,是Si,Si可作半导体材料;b是两个原子的化合物,根据其物理性质:无色无味气体,推断b为CO,CO一旦进入肺里,会与血液中的血红蛋白结合而使血红蛋白丧失输送氧气的能力,使人中毒;c是双原子单质,每个原子有7个电子,故c为N2,N2分子的结构式为N≡N,为非极性键,N2分子中的共价三键键能很大,所以N2分子很稳定;d是四核化合物,即4个原子共有14个电子,只能是烃,故d为C2H2,C2H2的结构式为H—C≡C—H,有两个H—C σ键,一个C—C σ键,两个π键,
(1)由以上分析可知,a为Si,核电荷数为14,原子核外电子排布式为1s22s22p63s23p2 ;综上所述,本题答案是:1s22s22p63s23p2。
(2) 由以上分析可知,b是CO,CO一旦被吸入肺里后,会与血液中的血红蛋白结合,使血红蛋白丧失输送氧气的能力,所以人一旦吸入CO气体后就易引起中毒;综上所述,本题答案是:CO,CO一旦被吸入肺里后,会与血液中的血红蛋白结合,使血红蛋白丧失输送氧气的能力。
(3) 由以上分析可知,c为N2,其电子式![]() ;分子中所含非极性键;由于N2分子中的共价三键键能很大,共价键很牢固,所以氮气单质常温下性质稳定,不易起反应;综上所述,本题答案是:
;分子中所含非极性键;由于N2分子中的共价三键键能很大,共价键很牢固,所以氮气单质常温下性质稳定,不易起反应;综上所述,本题答案是:![]() ,非极性键,N2分子中的共价三键键能很大,共价键很牢固。
,非极性键,N2分子中的共价三键键能很大,共价键很牢固。
(4) 由以上分析可知,d为C2H2,其结构式为H—C≡C—H;分子内所含共价键有3个σ键,2个π键;由于形成σ键的原子轨道的重叠程度比π键的重叠程度大,形成的共价键强,所以σ键与π键的强度:σ>π;
综上所述,本题答案是:H—C≡C—H;3,2 ,>,形成σ键的原子轨道的重叠程度比π键的重叠程度大,形成的共价键强。

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】以方潜矿(PbS)为原料制备铅蓄电池的电极材料的工艺流程如图所示:

部分化合物的Ksp如下表所示:
物质 | PbCl2 | PbS | PbCrO4 |
Ksp | 1.2×10-5 | 9.0×10-29 | 1.8×10-14 |
请回答下列问题:
(1)“焙烧”生成的气体可用于工业制备____________。
(2)写出“高温还原”的主要化学方程式:____________。
(3)“粗铅”的杂质主要有锌,铁,铜,银等,电解精炼时阴极反应式为____________。阳极泥的主要成分为____________。
(4)铅与稀盐酸反应产生少量气泡后反应终止,原因是____________。写出制备PbO2的离子方程式:____________。
(5)Pb(NO3)2是强酸弱碱盐,氢硫酸(H2S)是弱酸,向Pb(NO3)2溶液中通入H2S气体是否能产生黑色PbS沉淀____________?(列式计算说明,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15)。
(6)将PbCrO4加入足量硝酸中,部分振荡,观察到主要现象是____________,反应的离子方程式为____________。