题目内容
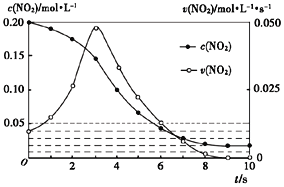
【题目】恒温25℃下,向一定量的0.1mol/L的BOH溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,pC=-1gc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是( )

A. BOH为弱碱且Kb的数量级为10—5
B. b点溶液呈中性
C. c-d点间溶液中:c(BOH)+c(OH—)>c(H+)
D. c点溶液中水的电离程度最大,且c(B+)<c(Cl—)
【答案】C
【解析】
A.由a点可知BOH电离出c(OH—)=10-14/10-11.3=10-2.7mol/L,则![]() ,则Kb的数量级为10—5,A项正确;
,则Kb的数量级为10—5,A项正确;
B.25℃下, b点c(H+)水=10-7mol/L ,此时为BOH和BCl的混合液,BOH对水的电离的抑制程度与BCl对水的电离的促进程度相同,则pH=7,即b点溶液呈中性,故B正确;
C.c点水的电离达到最大值,则此时溶质为BCl,由质子守恒有c(BOH)+c(OH—)=c(H+),c-d点过程中继续加盐酸,c(OH—)减小而c(H+)增大,则c(BOH)+c(OH—)<c(H+),C项错误;
D.c点水的电离程度最大,此时溶质为BCl,B+水解使溶液显酸性,则c(B+)<c(Cl—),D项正确。
本题选C。

 阅读快车系列答案
阅读快车系列答案【题目】以方潜矿(PbS)为原料制备铅蓄电池的电极材料的工艺流程如图所示:

部分化合物的Ksp如下表所示:
物质 | PbCl2 | PbS | PbCrO4 |
Ksp | 1.2×10-5 | 9.0×10-29 | 1.8×10-14 |
请回答下列问题:
(1)“焙烧”生成的气体可用于工业制备____________。
(2)写出“高温还原”的主要化学方程式:____________。
(3)“粗铅”的杂质主要有锌,铁,铜,银等,电解精炼时阴极反应式为____________。阳极泥的主要成分为____________。
(4)铅与稀盐酸反应产生少量气泡后反应终止,原因是____________。写出制备PbO2的离子方程式:____________。
(5)Pb(NO3)2是强酸弱碱盐,氢硫酸(H2S)是弱酸,向Pb(NO3)2溶液中通入H2S气体是否能产生黑色PbS沉淀____________?(列式计算说明,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15)。
(6)将PbCrO4加入足量硝酸中,部分振荡,观察到主要现象是____________,反应的离子方程式为____________。