题目内容
【题目】回答下列问题:
(1)下图为四种粒子的结构示意图,完成以下填空:
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
属于阳离子结构的粒子是________(填字母序号,下同);A粒子的半径________B粒子的半径(填“>”、“<”或“=”)。
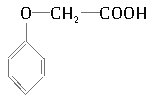
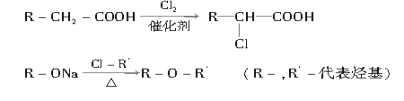
(2)有机物M经过太阳光光照可转化成N,转化过程如下:

![]()
 ΔH = +88.6 kJ·mol-1
ΔH = +88.6 kJ·mol-1
则M、N相比,较稳定的是____________。
(3) 由氢气和氧气反应生成1 mol水蒸气放出热量241.8 kJ,写出该反应的热化学方程式为:_____________________________________________________。
(4)一定温度下在某定容容器中发生反应:2A(g)+3B(g)![]() 2C(g),开始时,A的浓度为2 mol·L-1,B的浓度为4 mol·L-1,2 min后,A的浓度减少0.8 mol·L-1,则
2C(g),开始时,A的浓度为2 mol·L-1,B的浓度为4 mol·L-1,2 min后,A的浓度减少0.8 mol·L-1,则
① v(B)=____________,v(C)=__________。
② 在2 min末,C的浓度是__________,B的浓度是____________。
【答案】(1)B > (2) M (3)H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
(4)①v(B)=0.6mol/(L.min),v(C)=0.4 mol/(L.min);②c(C)=0.8mol/L,n(B)=2.8mol/L
【解析】
试题分析:(1)A表示F-,B表示Mg2+,C表示Na原子,D表示Al原子,故属于阳离子结构的离子是B,A和B具有相同的核外电子排布,因此核电荷数越大,半径越小,故A的半径>B的半径;
(2)物质的能量越高,越不稳定。由于M吸收热量生成N,因此N的能量高于M,故M更稳定;
(3)由氢气和氧气反应生成1 mol水蒸气放出热量241.8 kJ,对应的热化学方程式为:H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1;
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1;
(4)①
2A(g)+3B(g)![]() 2C(g)
2C(g)
起始浓度(mol·L-1) 2 4 0
转化浓度(mol·L-1) 0.8 1.2 0.8
2min末浓度(mol·L-1) 1.2 2.8 0.8
![]() ;
;
![]() ;
;
②2min末,C的浓度为0.8 mol·L-1,B的浓度为2.8 mol·L-1。