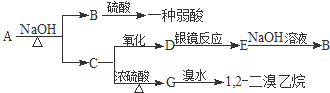
题目内容
10.某元素质量数51,中子数28,其基态原子未成对电子数为( )| A. | 4 | B. | 1 | C. | 2 | D. | 3 |
分析 质量数51,中子数28,则该元素原子的质子数为51-28=23,根据核外电子排布规律书写基态原子的电子排布式,据此判断.
解答 解:质量数51,中子数28,则该元素原子的质子数为51-28=23,
故该元素基态原子的电子排布式为:1s22s22p63s23p63d34s2,
3d能级具有5个轨道,3个电子优先分别占据1个轨道,且自旋方法相同,故有3个未成对电子,
故选D.
点评 本题考查核外电子排布规律等,难度不大,理解核外电子排布规律,注意能级处于全满、半满、全空时的稳定状态.

练习册系列答案
相关题目
20.现代化学中,常用来鉴定元素的方法( )
| A. | 红外光谱分析 | B. | X-射线衍射实验 | C. | 质谱分析 | D. | 光谱分析 |
1.反应2C+O2=2CO 的能量变化如右图所示.下列说法正确的是( )
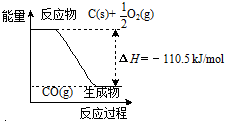

| A. | 12gC(s)与一定量O2(g)反应生成14g CO(g),放出的热量为110.5kJ | |
| B. | 该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 | |
| C. | 该反应的热化学方程式是2C(s)+O2(g)=2CO(g)△H=-221kJ | |
| D. | 2molC(s)与足量O2(g)反应生成CO2(g),放出的热量大于221kJ |
5.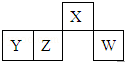 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
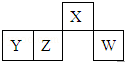 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | X的氢化物与氯化氢反应的产物溶于水形成的溶液呈酸性 | |
| C. | 最简单气态氢化物的热稳定性:Z>W | |
| D. | 含Y元素的盐溶液一定显酸性 |
15.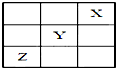 元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )
元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )
 元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )
元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )| A. | X元素所在周期中所含非金属元素最多 | |
| B. | Y元素在周期表的第3周期ⅥA族 | |
| C. | Y元素基态原子的价电子排布为4s24p4 | |
| D. | Z元素基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
2.向AgNO3溶液中加入过量氨水,可生成[Ag(NH3)2]OH.下列说法正确的是( )
| A. | 氨气极易溶于水,所得的氨水中存在3种不同的氢键 | |
| B. | [Ag(NH3)2]+ 中含有6个σ键 | |
| C. | [Ag(NH3)2]OH所含有的化学键有离子键、极性共价键和配位键 | |
| D. | 在[Ag(NH3)2]+离子中Ag+给出孤对电子,NH3提供空轨道 |