题目内容
10.下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题: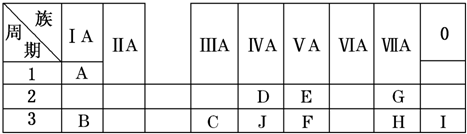
(1)表中元素,化学性质最不活泼的是Ar,只有负价而无正价的元素是F.
(2)C元素在元素周期表中的位置是第3周期第ⅢA族.
(3)最高价氧化物的水化物酸性最强的是HClO4,呈两性的是Al(OH)3.
(4)A分别与E、G、H形成的化合物中,最稳定的是HF.
(5)在B、C、E、F中,原子半径最大的是Na.
(6)B、H两种元素所形成的化合物所含的化学键类型为离子键.
(7)写出C的最高价氧化物与H的氢化物之间反应的离子方程式Al2O3+6H+═2Al3++3H2O.
(8)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O.
分析 由元素在周期表中位置,可知A为氢、B为Na、C为Al、D为碳、E为氮、F为磷、G为氟、H为Cl、I为Ar、J为Si.
(1)稀有气体原子最外层为稳定结构,化学性质最不活泼;上述元素中氟元素没有正化合价;
(2)由C的位置可知,C处于第三周期ⅢA族;
(3)高氯酸的酸性最强,氢氧化铝是两性氢氧化物;
(4)元素非金属性越强,其氢化物越稳定;
(5)同周期自左而右原子半径减小、同主族自上而下原子半径增大;
(6)B、H形成的化合物为NaCl,由活泼金属与活泼非金属组成;
(7)氧化铝与盐酸反应生成氯化铝与水;
(8)B与C两种元素的最高价氧化物对应的水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水.
解答 解:由元素在周期表中位置,可知A为氢、B为Na、C为Al、D为碳、E为氮、F为磷、G为氟、H为Cl、I为Ar、J为Si.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼;上述元素中氟元素没有正化合价,只有负价,故答案为:Ar;F;
(2)由C的位置可知,C处于第三周期ⅢA族,故答案为:ⅢA;
(3)HClO4是最强的无机含氧酸,Al(OH)3是两性氢氧化物,故答案为:HClO4;Al(OH)3;
(4)N、C、F三元素中F元素非金属性最强,元素非金属性越强,其氢化物越稳定,故HF最稳定,故答案为:HF;
(5)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Na>Al>P>N,故答案为:Na;
(6)B、H形成的化合物为NaCl,由活泼金属与活泼非金属组成,含有离子键,故答案为:离子键;
(7)氧化铝与盐酸反应生成氯化铝与水,反应离子方程式为:Al2O3+6H+═2Al3++3H2O,故答案为:Al2O3+6H+═2Al3++3H2O;
(8)B与C两种元素的最高价氧化物对应的水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水,化学方程式为:Al(OH)3+NaOH═NaAlO2+2H2O,故答案为:Al(OH)3+NaOH═NaAlO2+2H2O.
点评 本题考查元素周期表与元素周期律综合应用,难度不大,侧重对基础知识的巩固.

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案| A. | 同一化学反应中用各反应物及各生成物表示的速度相等 | |
| B. | 无论何种反应,在其它条件不变的情况下,升温速度则加快 | |
| C. | 无论何种反应改变压强就能改变其速度 | |
| D. | 用单位时间内某物质浓度的改变量所表示的速度是即时速度 |
| A. | SO2、O2分别为0.8 mol/L、0.4mol/L | B. | SO2为0.5mol/L | ||
| C. | SO2、SO3均为0.3mol/L | D. | SO2为0.5mol/L,SO3为0.2 mol/L |
| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | △H>0表示放热,△H<0表示吸热 | |
| C. | 0.5mol H2SO4与0.5molBa(OH)2反应生成1mol水时放出的热叫做中和热 | |
| D. | 1molH2与0.5molO2燃烧放出的热就是H2的燃烧热 |
①核内质子数 ②核外电子数 ③最外层电子数 ④核外电子层数.
| A. | ①② | B. | ③④ | C. | ①②③ | D. | ②③④ |
| A. | “地沟油”禁止食用,但可以用来做燃料 | |
| B. | 减少机动车尾气的排放,可以降低雾霾的发生 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 |
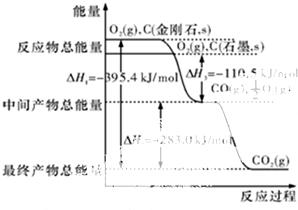 能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措.
能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措.