题目内容
18.已知硼有两种同位素10B和11B.在100g硼中,10B占18.5g.计算:(1)100g硼中10B和11B的物质的量.
(2)硼的相对平均原子质量.
分析 (1)设硼的有两种同位素10B和11B的物质的量分别为x、y,根据m=nM计算;
(2)根据元素的相对平均原子质量为该元素各同位素与占总量的百分比的乘积之和计算.
解答 解:(1)设硼的有两种同位素10B和11B的物质的量分别为x、y,100g硼中
10x+11y=100g,10x=18.5g,解得:x=1.85,y≈7.41,
答:100g硼中10B和11B的物质的量分别为:1.85、7.41;
(2)100g硼中,10B占18.5g,该同位素占总量的百分比为18.5%,则11B占总量的百分比为81.5%,硼的平均相对原子质量=10×18.5%+11×81.5%=10.815,
答:硼的相对平均原子质量为10.815.
点评 本题考查物质的量的计算,题目难度不大.正确理解元素的相对平均原子质量的计算方法是解本题关键.

练习册系列答案
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
8.(1)向一定体积的密闭容器中加入2molA、0.6molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图I所示,其中t0~t1阶段c(B)画出.图Ⅱ为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中t3~t4阶段为使用催化剂.
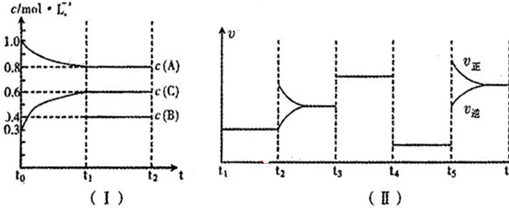
请回答下列问题:
①若t1=30min,则t0~t1阶段以C物质的浓度变化表示的反应速率为0.01 mol/(L•min);
②t4~t5阶段改变的条件为减小压强,B的起始物质的量浓度为0.5mol/L.各阶段平衡时对应的平衡常数如下表所示:
K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5(用“>”、“<”或“=”连接);
③t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为aKJ,写出此温度下该反应的热化学方程式:2A(g)+B(g) 3C(g)△H=+200a kJ/mol
3C(g)△H=+200a kJ/mol
(2)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是硫酸锰或Mn2+的催化作用的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是B
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰.

请回答下列问题:
①若t1=30min,则t0~t1阶段以C物质的浓度变化表示的反应速率为0.01 mol/(L•min);
②t4~t5阶段改变的条件为减小压强,B的起始物质的量浓度为0.5mol/L.各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
③t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为aKJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)
 3C(g)△H=+200a kJ/mol
3C(g)△H=+200a kJ/mol(2)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是硫酸锰或Mn2+的催化作用的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是B
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰.
9.化学与生活、生产、环境等密切相关.下列说法错误的是( )
| A. | 煤的液化、石油的裂化和油脂的皂化都属于化学变化 | |
| B. | 糖、油脂和蛋白质都是人体生命活动所需的基本营养物质 | |
| C. | 静电除尘、燃煤固硫和汽车尾气催化净化都有利于改善空气质量 | |
| D. | 硝酸纤维、聚酯纤维和光导纤维都可由纤维素在一定条件下制得 |
6.乙烷与氯气在光照条件先发生取代反应所得有机产物数目共有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
13.A气体的水溶液呈酸性,若将A通入酸性的KMnO4溶液中,则紫红色褪色;若将A通入Br2水中,则Br2褪色并出现浑浊,则A气体是( )
| A. | Cl2 | B. | SO2 | C. | H2S | D. | CO2 |
7.元素周期表是化学学习和科学研究的重要工具,下列对于元素周期表的使用方法不正确的是( )
| A. | 为新元素的发现及预测它们的原子结构和性质提供线索 | |
| B. | 利用元素周期表发现元素的种类和原子的种类相同 | |
| C. | 在周期表中金属与非金属的分界处,可寻找半导体材料 | |
| D. | 指导人们在过渡元素中寻找催化剂和耐高温.耐腐蚀的合金材料 |

 ,⑩与⑨形成的5原子分子的结构式为
,⑩与⑨形成的5原子分子的结构式为 .
. ,氢化物X与化合物Y发生反应的离子方程式为S2-+H2O2=S↓+2OH-.
,氢化物X与化合物Y发生反应的离子方程式为S2-+H2O2=S↓+2OH-.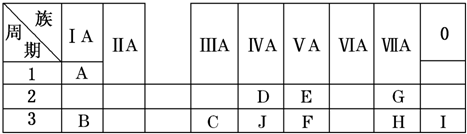
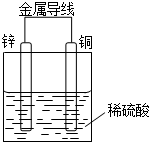 某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告
某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告