题目内容
12.碱性锌锰电池的总反应是:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,电解质是KOH.下列说法正确的是( )| A. | MnO2发生了氧化反应 | |
| B. | MnOOH中Mn元素的化合价为+3 | |
| C. | 反应消耗 0.65g Zn,有0.01 mol电子发生转移 | |
| D. | 碱性锌锰电池是一种高效、环境友好的发电装置 |
分析 由碱性锌锰电池的总反应:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,可知电池的负极Zn是电子被氧化,电极反应式为:Zn+2OH--2e-═Zn(OH)2,正极MnO2得电子被还原生成MnOOH,反应式为2MnO2+2H2O+2e-═2MnOOH+2OH-,以此解答.
解答 解:A.由碱性锌锰电池的总反应:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,可知正极MnO2得电子被还原生成MnOOH,故A错误;
B.MnOOH中O元素化合价为-2价,H元素化合价为+1价,根据化合价代数和为0,则Mn元素的化合价为+3,故B正确;
C.n(Zn)=0.01mol,有0.02mol电子发生转移,故C错误;
D.碱性锌锰电池含有重金属,有污染,故D错误.
故选B.
点评 本题考查原电池工作原理,题目难度不大,本题注意根据电池总反应式判断正负极反应,注意电极反应式的书写.

练习册系列答案
相关题目
2.下列叙述正确的是( )
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生 ②浓硫酸可用于干燥氢气、碘化氢等气体,但不能干燥氨气、二氧化氮气体 ③Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱 ④玻璃、水泥、水晶项链都是硅酸盐制品 ⑤浓硫酸与铜反应既体现了其强氧化性又体现了其酸性 ⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得到相同的物质.
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生 ②浓硫酸可用于干燥氢气、碘化氢等气体,但不能干燥氨气、二氧化氮气体 ③Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱 ④玻璃、水泥、水晶项链都是硅酸盐制品 ⑤浓硫酸与铜反应既体现了其强氧化性又体现了其酸性 ⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得到相同的物质.
| A. | ①④⑤ | B. | ①⑤⑥ | C. | ②③④ | D. | ④⑤⑥ |
3.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法不能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| ① | 苯(苯酚) | 氢氧化钠溶液 | 分液 |
| ② | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| ③ | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
| ④ | 乙炔(硫化氢) | 硫酸铜 | 洗气 |
| A. | ②③④ | B. | ②③ | C. | ③④ | D. | ③ |
17.某化合物,其组成中没有C、H、O三种元素.这种化合物可能属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 有机物 |
1.两气体A和B的摩尔质量之比为3:1,则它们在同温、同压、同体积时的分子个数比应为( )
| A. | 1:1 | B. | 1:3 | C. | 3:1 | D. | 9:1 |
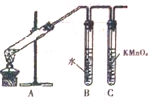 为探究溴乙烷与NaOH乙醇溶液发生反应后生成的气体中是否含不饱和烃的装置如图所示.回答:
为探究溴乙烷与NaOH乙醇溶液发生反应后生成的气体中是否含不饱和烃的装置如图所示.回答: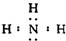 ,化学键类型为共价键;
,化学键类型为共价键;