题目内容
3.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法不能达到实验目的是( )| 混合物 | 试剂 | 分离方法 | |
| ① | 苯(苯酚) | 氢氧化钠溶液 | 分液 |
| ② | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| ③ | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
| ④ | 乙炔(硫化氢) | 硫酸铜 | 洗气 |
| A. | ②③④ | B. | ②③ | C. | ③④ | D. | ③ |
分析 ①苯酚与NaOH反应后,与苯分层;
②乙烯被高锰酸钾氧化生成二氧化碳;
③二者均与NaOH反应;
④硫化氢与硫酸铜反应,而乙炔不能.
解答 解:①苯酚与NaOH反应后,与苯分层,然后分液可除杂,故正确;
②乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质,应选溴水、洗气除杂,故错误;
③二者均与NaOH反应,不能除杂,应选饱和碳酸钠、洗气除杂,故错误;
④硫化氢与硫酸铜反应,而乙炔不能,则加硫酸铜、洗气可除杂,故正确;
故选B.
点评 本题考查混合物的分离提纯,为高频考点,把握发生的反应及混合物分离提纯方法为解答的关键,侧重分析与应用能力的考查,注意除杂的原则,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.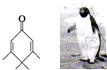 如图的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来取名为Penguinone.下列有关Penguinone的说法正确的是( )
如图的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来取名为Penguinone.下列有关Penguinone的说法正确的是( )
 如图的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来取名为Penguinone.下列有关Penguinone的说法正确的是( )
如图的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来取名为Penguinone.下列有关Penguinone的说法正确的是( )| A. | 若与Penguinone互为同分异构体的酚类且苯环上只有两个取代基的有机物有9种 | |
| B. | Penguinone分子中所有碳原子可能处于同一平面 | |
| C. | Penguinone分子中无酚羟基所以不能使酸性高锰酸钾溶液褪色 | |
| D. | Penguinone分子式为C10H14O |
8.下列说法中,错误的是( )
| A. | 石油分馏所得的馏分仍是混合物 | |
| B. | 天然气的主要成分是甲烷、乙烯等气体 | |
| C. | 煤焦油经分馏可得苯和甲苯 | |
| D. | 含C20以上的重油经催化裂化可得汽油、柴油等轻质油 |
12.碱性锌锰电池的总反应是:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,电解质是KOH.下列说法正确的是( )
| A. | MnO2发生了氧化反应 | |
| B. | MnOOH中Mn元素的化合价为+3 | |
| C. | 反应消耗 0.65g Zn,有0.01 mol电子发生转移 | |
| D. | 碱性锌锰电池是一种高效、环境友好的发电装置 |

 .
.