题目内容
2.已知X、Y、Z、W是短周期中的四种元素,它们的原子序数依次增大.X和Y可形成常见化合物YX4,一个YX4分子中电子总数为10.Z单质在通常状况下为无色无味气体.W原子的最外层电子数是核外电子总数的3/4.试回答:(1)X单质和Z单质在一定条件下可生成化合物E:
①E的电子式为
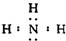 ,化学键类型为共价键;
,化学键类型为共价键;②工业上制取E的化学方程式为(注明反应条件):N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;
③干燥E时使用的干燥剂为碱石灰;
(2)由X、Z、W三种元素可以组成一种盐,该盐是常用速效化肥,但长期使用会增加土壤的酸性,其原因是(用离子方程式表示)NH4++H2O?NH3•H2O+H+;
(3)将9g Y单质在足量W单质中燃烧,所得气体通入1L 1mol/L NaOH溶液中,完全反应后,所得溶液中各种离子的物质的量浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
分析 X、Y、Z、W是短周期中的四种元素,它们的原子序数依次增大.X和Y可形成常见化合物YX4,一个YX4分子中电子总数为10,则Y为C元素、X为H元素;W原子的最外层电子数是核外电子总数的$\frac{3}{4}$,原子只能有2个电子层,设最外层电子数为a,则(2+a)×$\frac{3}{4}$=a,故a=6,则W为O元素;Z单质在通常状况下为无色无味气体,原子序数介于碳、氧之间,故Z为N元素,据此解答.
解答 解:X、Y、Z、W是短周期中的四种元素,它们的原子序数依次增大.X和Y可形成常见化合物YX4,一个YX4分子中电子总数为10,则Y为C元素、X为H元素;W原子的最外层电子数是核外电子总数的$\frac{3}{4}$,原子只能有2个电子层,设最外层电子数为a,则(2+a)×$\frac{3}{4}$=a,故a=6,则W为O元素;Z单质在通常状况下为无色无味气体,原子序数介于碳、氧之间,故Z为N元素.
(1)X单质和Z单质在一定条件下可生成化合物E为NH3,
①NH3的电子式为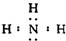 ,化学键类型为:共价键,故答案为:
,化学键类型为:共价键,故答案为: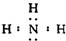 ;共价键;
;共价键;
②工业上制取氨气的化学方程式为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,故答案为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;
③干燥氨气时使用的干燥剂为:碱石灰,故答案为:碱石灰;
(2)由H、N、O三种元素可以组成一种盐,该盐是常用速效化肥,该盐为硝酸铵,由于铵根离子水解:NH4++H2O?NH3•H2O+H+,但长期使用会增加土壤的酸性,
故答案为:NH4++H2O?NH3•H2O+H+;
(3)9gC的物质的量=$\frac{9g}{12g/mol}$=0.75mol,根据碳原子守恒得n(CO2)=n(C)=0.75mol,n(NaOH)=1mol/L×1L=1mol,1<n(NaOH):n(CO2)<2,所以二氧化碳和氢氧化钠反应后的溶液中存在碳酸钠和碳酸氢钠,设n(Na2CO3)=xmol,n(NaHCO3)=ymol,根据钠原子和碳原子守恒得:$\left\{\begin{array}{l}{x+y=0.75}\\{2x+y=1}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.25}\\{y=0.5}\end{array}\right.$,根据物料守恒知c(Na+)最大,溶液呈碱性,故c(OH-)>c(H+),水解、电离程度都很小,所以c(HCO3-)>c(CO32-),则离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评 本题考查位置结构性质的相互关系,正确推断元素是解本题关键,是对学生综合能力考查,难度中等.

| A. | MnO2发生了氧化反应 | |
| B. | MnOOH中Mn元素的化合价为+3 | |
| C. | 反应消耗 0.65g Zn,有0.01 mol电子发生转移 | |
| D. | 碱性锌锰电池是一种高效、环境友好的发电装置 |
| 实验步骤和方法 | 实验现象 |
| ①把6瓶液体分别依次标号A、B、C、D、E、F,然后闻气味 | 只有F没有气味 |
| ②各取少量于试管中,加水稀释 | 只有C、D、E不溶解而浮在水面上 |
| ③分别取少量6种液体于试管中,加新制Cu(OH)并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且在D的试管中闻到特殊香味 |
(2)在D中加入NaOH溶液并加热的化学方程式为CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH.
(3)C的二氯代物有三种同分异构体;
(4)若将1mol乙醇(其中的羟基氧用18O标记)在浓硫酸存在下并加热与足量乙酸充分反应.则生成的乙酸乙酯的质量大于88g(填:大于,小于或等于)
(5)已知乙醛发生银镜反的方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{加热}{→}$CH3COONH4+H2O+2Ag↓+3NH3,试写出葡萄糖发生银镜反应的化学方程式CH2OH(CHOH)4CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+H2O+3NH3.
| A. | 阿伏伽德罗常数是指1mol物质中所含有的原子数 | |
| B. | 微粒的数目与物质的量成正比 | |
| C. | 国际上规定0.012kg12C中所含碳原子数为阿伏伽德罗常数 | |
| D. | 1mol O2中的分子数为NA,而原子数为2NA |
| A. | 实现H2→H+H的变化,要放出能量 | |
| B. | 液态水变成气态水要吸收能量 | |
| C. | 金刚石在一定条件变成石墨要吸收能量 | |
| D. | CaO和水反应过程中焓变大于0 |
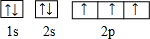 ,这样的排布遵循了泡利原理和洪特规则.
,这样的排布遵循了泡利原理和洪特规则.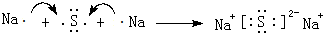 .
.