题目内容
12.下列依据相关实验得出的结论正确的是( )| 编号 | 实 验 | 结 论 |
| A | 向某溶液中加入稀盐酸,将产生的气体通入澄清石灰水,石灰水变浑浊 | 该溶液一定是碳酸盐溶液 |
| B | 向样品溶液中先滴加过量的稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀,说明样品溶液中一定含有SO42- |
| C | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成,表明淀粉没有水解生成葡萄糖 |
| D | 向0.1mol•L-1 Na2CO3溶液中,滴加2滴酚酞显浅红色,微热 | 浅红色加深,说明Na2CO3的水解是吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.可能为SO32-或HCO3-等离子;
B.滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀,可排除Cl-和SO32-的影响;
C.葡萄糖在碱性条件下与新制Cu(OH)2浊液反应;
D.盐类水解都是吸热反应,加热促进盐类的水解.
解答 解:A.能与酸反应生成使澄清石灰水变浑浊的气体的可能为SO32-或HCO3-等离子,不一定为CO32-,故A错误;
B.滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀,可排除Cl-和SO32-的影响,可说明样品溶液中一定含有SO42-,故B正确;
C.葡萄糖与新制Cu(OH)2浊液反应需在碱性条件下,应加入碱将水解后的淀粉溶液调节成碱性,才可以产生砖红色沉淀,故C错误;
D.碳酸钠为强碱弱酸盐,水解显碱性,盐类的水解是吸热过程,所以加热促进碳酸钠的水解,碱性增强,故D正确;
故选BD.
点评 本题考查化学实验方案的评价,涉及物质的性质探究、离子检验等,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型,注意把握物质的性质以及实验的严密性和可行性的评价,难度中等.

练习册系列答案
相关题目
18.已知0.1mol•L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )
| A. | 在Na2A、NaHA两溶液中,离子种类相同 | |
| B. | 在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等 | |
| C. | NaHA溶液pH一定大于7 | |
| D. | 在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-) |
3.下列指定溶液中,一定能大量共存的离子组是( )
| A. | 常温下,由水电离出的氢离子浓度c(H+)=1×10-13mol/L的溶液中:Fe2+、NO3-、Ba2+、Cl- | |
| B. | 含有大量Al3+的溶液中:Na+、K+、NO3-、SiO32- | |
| C. | 无色透明溶液中:Mg2+、Fe3+、SO42-、SCN- | |
| D. | pH=13的溶液中:AlO2-、Na+、Cl-、CO32- |
20.以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )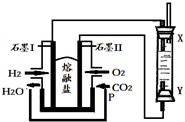

| A. | X、Y两端都必须用铁作电极 | |
| B. | 不可以用NaOH溶液作为电解液 | |
| C. | 阴极发生的反应是:2H2O+2e-=H2↑+2OH- | |
| D. | X端为电解池的阳极 |
7.在化学学习与研究中经常采用“推理”的思维方式,但有时也会得出错误的结论.下列“推理”正确的是( )
| A. | 较强酸可以制取较弱酸,推出H2S不能制取H2SO4 | |
| B. | 组成和结构相似的物质,沸点随相对分子质量增大而升高,推出SiH4沸点高于CH4 | |
| C. | 电解氯化铜溶液可得到Cu;则电解食盐水可以得到Na | |
| D. | 1mol O2和Mg完全反应获得4mol电子;则1mo1 O2和其他金属完全反应都获得4mol电子 |
17. 柴静在《穹顶之下》中介绍到雾霾中含有较大量的一种突变原和致癌物质--苯并[a]芘(Benzo-a-pyrene)(BAP).苯并芘是一种五环多环芳香烃类(结构如图所示),存在于汽车废气(尤其是柴油引擎)、烟草与木材燃烧产生的烟,以及炭烤食物中.关于苯并[a]芘的下列说法中正确的是( )
柴静在《穹顶之下》中介绍到雾霾中含有较大量的一种突变原和致癌物质--苯并[a]芘(Benzo-a-pyrene)(BAP).苯并芘是一种五环多环芳香烃类(结构如图所示),存在于汽车废气(尤其是柴油引擎)、烟草与木材燃烧产生的烟,以及炭烤食物中.关于苯并[a]芘的下列说法中正确的是( )
 柴静在《穹顶之下》中介绍到雾霾中含有较大量的一种突变原和致癌物质--苯并[a]芘(Benzo-a-pyrene)(BAP).苯并芘是一种五环多环芳香烃类(结构如图所示),存在于汽车废气(尤其是柴油引擎)、烟草与木材燃烧产生的烟,以及炭烤食物中.关于苯并[a]芘的下列说法中正确的是( )
柴静在《穹顶之下》中介绍到雾霾中含有较大量的一种突变原和致癌物质--苯并[a]芘(Benzo-a-pyrene)(BAP).苯并芘是一种五环多环芳香烃类(结构如图所示),存在于汽车废气(尤其是柴油引擎)、烟草与木材燃烧产生的烟,以及炭烤食物中.关于苯并[a]芘的下列说法中正确的是( )| A. | BAP导电性优良,因其有共轭双键结构 | |
| B. | 五环多环芳香烃类都是BAP的同分异构体 | |
| C. | BAP有10种一硝基取代物 | |
| D. | BAP的分子式为C20H12 |
4.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D的单质中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F单质中燃烧,产物溶于水得到一种强酸.下列有关说法正确的是( )
| A. | 工业上F单质用MnO2和AF来制备 | |
| B. | A与D元素所形成的化合物中只含极性键 | |
| C. | F所形成的氢化物的酸性强于BD2的水化物的酸性,说明F的非金属性强于B | |
| D. | 由化学键角度推断,能形成BDF2这种化合物 |
1.X、Y、Z、W是元素周期表中前四周期中的常见元素,其相关信息如下表:
(1)Z位于元素周期表第二周期第VA族,W的基态原子核外有4个未成对电子.
(2)Z的气态氢化物比Y的气态氢化物熔点NH3 (填“高”或“低”),原因是NH3分子间形成氢键
(3)X与Y可形成多种化合物,其中以直线型存在的4核分子中σ键与π键之比为3:2,
(4)Z与X组成的一种气态化合物还原性较强,试写出还原CuO且产物对环境无污染的化学方程式:2NH3+3CuO═3Cu+N2+3H2O
(5)可用YX4还原ZOx以消除污染.
YX4(g)+4ZO2(g)=4ZO(g)+YO2(g)+2X2O(g)△H=-574.0KJ?mol
YX4(g)+4ZO(g)=2Z2(g)+YO2(g)+2X2O(g) H=-1160.0KJ/mol
试写出YX4还原ZO2至Z2的热化学方程式:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867.0KJ?mol.
| 元素 | 相关信息 |
| X | X的单质是密度最小的气体. |
| Y | Y的一种核素常用于考古且其一种同素异形体是较软的物质之一. |
| Z | Z是其气态氢化物的水溶液显碱性的元素. |
| W | W是地壳中含量居于第二位的金属. |
(2)Z的气态氢化物比Y的气态氢化物熔点NH3 (填“高”或“低”),原因是NH3分子间形成氢键
(3)X与Y可形成多种化合物,其中以直线型存在的4核分子中σ键与π键之比为3:2,
(4)Z与X组成的一种气态化合物还原性较强,试写出还原CuO且产物对环境无污染的化学方程式:2NH3+3CuO═3Cu+N2+3H2O
(5)可用YX4还原ZOx以消除污染.
YX4(g)+4ZO2(g)=4ZO(g)+YO2(g)+2X2O(g)△H=-574.0KJ?mol
YX4(g)+4ZO(g)=2Z2(g)+YO2(g)+2X2O(g) H=-1160.0KJ/mol
试写出YX4还原ZO2至Z2的热化学方程式:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867.0KJ?mol.