题目内容
下列实验现象与氧化还原反应有关的是
| A.SO2通入品红溶液中,溶液褪色 |
| B.新制氯水密闭放置一段时间后浅黄绿色消失 |
| C.向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
| D.向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 |
B
解析试题分析:A.SO2有漂白性,能使某些有色物质结合产生无色的物质而褪色,如通入品红溶液中,溶液褪色。这是结合漂白,与氧化还原反应无关。错误。B.在新制的氯水中发生反应: Cl2+H2O HCl +HClO,放置一段时间后发生反应:2HClO
HCl +HClO,放置一段时间后发生反应:2HClO 2HCl+O2↑。这两个反应都是氧化还原反应。由于HClO的浓度减小,平衡正向移动,Cl2的浓度不断减小,所以放置一段时间后浅黄绿色消失。正确。C.发生反应:Fe3++3OH-=Fe(OH)3↓. 该反应是复分解反应,不属于氧化还原反应。错误。D.发生反应:2H+ +SiO32-=H2SiO3↓。该反应是复分解反应,不属于氧化还原反应。错误。
2HCl+O2↑。这两个反应都是氧化还原反应。由于HClO的浓度减小,平衡正向移动,Cl2的浓度不断减小,所以放置一段时间后浅黄绿色消失。正确。C.发生反应:Fe3++3OH-=Fe(OH)3↓. 该反应是复分解反应,不属于氧化还原反应。错误。D.发生反应:2H+ +SiO32-=H2SiO3↓。该反应是复分解反应,不属于氧化还原反应。错误。
考点:考查判断反应现象与氧化还原反应的关系的这是。

练习册系列答案
相关题目
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应类型属于阴影部分的是
| A.2Na2O2+2H2O=4NaOH+O2↑ |
B.NH4HCO3 NH3↑+CO2↑+H2O NH3↑+CO2↑+H2O |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.Br2+2KI=I2+2KBr |
制取下列物质一定有氧化还原反应发生的是
| A.NH3 | B.Mg | C.FeCl3 | D.NaAlO2 |
废切削液中含2%—5%的NaNO2,直接排放会造成环境污染,下述试剂中能使其转化为无污染的N2的是
| A.H2O2 | B.NH4Cl | C.NaCl | D.浓H2SO4 |
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为
| A.135 L | B.90 L | C.168 L | D.157 L |
下列四种基本类型反应中一定属于氧化还原反应的是( )
| A.复分解反应 | B.分解反应 | C.化合反应 | D.置换反应 |
将69 g NO2(含少量N2O4)通入水中,关于此过程下列说法正确的是(NA表示阿伏加德罗常数)
| A.69 g NO2与N2O4混合气体所含原子数介于4.5 NA至9.0 NA之间 |
| B.此反应中转移的电子数为NA |
| C.最终可收集到11.2 L无色气体 |
| D.若将所得硝酸制成浓硝酸,常温下最多可溶解0.25 mol铁。 |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是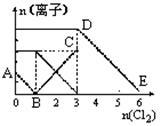
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中n(FeBr2)=3mol |
| C.当通入Cl22mol时,溶液中已发生的离子反应可表示为: 2Fe2++2I-+2C12=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+):n(I-):n(Br-)=3:1: 2 |
在下列变化中,需要加入合适的氧化剂才能实现的是( )
| A.HCl→H2 | B.CO2→CO | C.Fe2O3→Fe | D.Br-→Br2 |