题目内容
5.能用离子方程式H++OH-→H2O表示的反应是( )| A. | 稀硫酸和氢氧化钾溶液 | B. | 醋酸和氢氧化钡溶液 | ||
| C. | 氢硫酸和氢氧化钠溶液 | D. | 稀硝酸和氨水 |
分析 强酸与强碱生成可溶性盐和水的离子反应可以用H++OH-═H2O来表示,以此来解答.
解答 解:A.生成硫酸钾和水,反应的离子方程式为H++OH-=H2O,故A正确;
B.醋酸为弱酸,应写成化学式,反应的离子方程式为CH3COOH+OH-=CH3COO-+H2O,故B错误;
C.氢硫酸为弱酸,应写成化学式,反应的离子方程式为H2S+2OH-=S2-+2H2O,故C错误;
D.一水合氨为弱碱,离子方程式为NH3•H2O+H+=NH4++H2O,故D错误.
故选A.
点评 本题考查离子反应书写,为高考常见题型,侧重学生思维严密性的考查,把握离子反应书写方法及离子反应中保留化学式的物质为解答的关键,题目难度不大.

练习册系列答案
相关题目
15.下列离子方程式正确的是( )
| A. | 把少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═2HClO+CaSO3↓ | |
| B. | 足量铁屑溶于稀硫酸:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-═CO32-+H2O | |
| D. | 铝片溶于烧碱溶液:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
16.下列实验能达到目的是( )
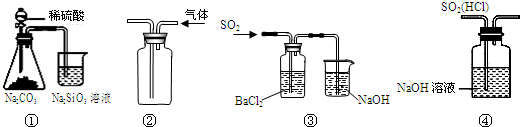

| A. | 图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②装置收集CO2气体 | |
| C. | 用图③装置制备BaSO3沉淀 | |
| D. | 用图④装置除去SO2中的HCl |
13.下列说法不正确的是( )
| A. | 液化石油气(LPG)的主要成份是碳氢化合物 | |
| B. | 光化学烟雾是氮氧化物和烃的排放引发的环境污染 | |
| C. | CHCl3不存在同分异构体,可以证明甲烷是以碳原子为中心的正四面体结构 | |
| D. | 甲烷与二氧化碳一样,也是一种温室气体 |
20.下列各项中,( )是决定化学反应速率的最主要因素.
| A. | 反应物化学性质 | B. | 温度 | C. | 反应物浓度 | D. | 催化剂 |
10.以下实验事实可以证明一水合氨是弱电解质的是( )
①0.1mol/L的氨水可以使酚酞溶液变红 ②0.1mol/L的氯化铵溶液的pH约为5 ③0.1mol/L的氨水的pH值为11.2 ④铵盐受热易分解.
①0.1mol/L的氨水可以使酚酞溶液变红 ②0.1mol/L的氯化铵溶液的pH约为5 ③0.1mol/L的氨水的pH值为11.2 ④铵盐受热易分解.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
17.硼是植物生长发育必需的微量元素之一,硼玻璃纤维用作火箭的防护材料.下列关于硼的叙述正确的是( )
| A. | 它位于元素周期表第二周期第ⅡA族 | B. | 硼酸是弱酸 | ||
| C. | 硼的金属性比铝强 | D. | 硼的原子半径比碳小 |
14.已知0.5mol某烃X能与1mol HCl完全加成得到Y,0.5mol Y能与3mol Cl2完全取代得到Z,则X的结构简式可能是( )
| A. | CH2=CH2 | B. | CH≡CH | C. | CH2=CHCl | D. | CH≡CCH3 |
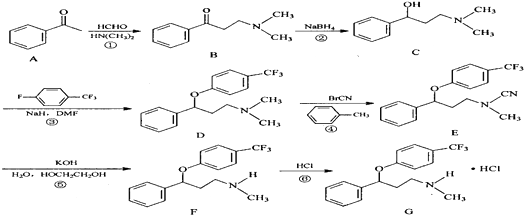
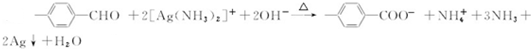
 .
.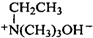 $\stackrel{△}{→}$CH2=CH2;请写出以
$\stackrel{△}{→}$CH2=CH2;请写出以 、HCHO、HN(CH3)2为有机原料,合成
、HCHO、HN(CH3)2为有机原料,合成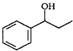 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$ CH3CH2OH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$ CH3CH2OH.