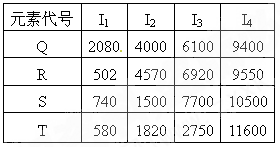
题目内容
(8分)(2011·济南一模)海水中蕴藏着丰富的资源,人类需要的很多材料都来源于海水的综合利用。
(1)工业上用NaCl制备金属钠的化学方程式是____________________________________
________________________________________________________________________。
(2)实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为________(忽略反应前后溶液的体积变化)。
(3)电解氯化钠溶液可制备“84消毒液”(主要成分是次氯酸钠),通电时氯气被溶液完全吸收。假设所得的消毒液仅含一种溶质,请写出相应的总化学方程式________________________________________________________________________。
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
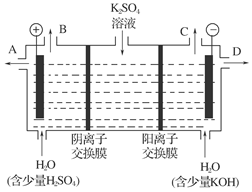
①该电解槽的阳极反应式为:_______________________________________________;
通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”或“D”)________导出。
③请简述通电开始后,阴极附近溶液pH变化的原因:____________________。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃烧电池,则电池正极的电极反应式为_______________________________________________________。
(1)工业上用NaCl制备金属钠的化学方程式是____________________________________
________________________________________________________________________。
(2)实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为________(忽略反应前后溶液的体积变化)。
(3)电解氯化钠溶液可制备“84消毒液”(主要成分是次氯酸钠),通电时氯气被溶液完全吸收。假设所得的消毒液仅含一种溶质,请写出相应的总化学方程式________________________________________________________________________。
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为:_______________________________________________;
通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”或“D”)________导出。
③请简述通电开始后,阴极附近溶液pH变化的原因:____________________。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃烧电池,则电池正极的电极反应式为_______________________________________________________。
(1)2NaCl(熔融)2Na+Cl2↑'(2)13
(3)NaCl+H2ONaClO+H2↑
(4)①4OH--4e-===2H2O+O2↑'小于'②D
③H+放电,促进水的电离,OH-浓度增大
④O2+2H2O+4e-===4OH-
(3)NaCl+H2ONaClO+H2↑
(4)①4OH--4e-===2H2O+O2↑'小于'②D
③H+放电,促进水的电离,OH-浓度增大
④O2+2H2O+4e-===4OH-
(1)工业上通过电解熔融氯化钠来制备钠。(2)电解氯化钠溶液的化学方程式为:2NaCl+2H2O2NaOH+H2↑+Cl2↑,当阴阳两极均得到112 mL标准状况下的气体时,生成NaOH的物质的量为0.01 mol,此时溶液中c(OH-)==0.1 mol/L,则pH=13。 (3)电解氯化钠溶液制备次氯酸钠可以分为两步,第一步:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;第二步:Cl2+2NaOH===NaCl+NaClO+H2O。将两步合并即得:NaCl+H2ONaClO+H2↑。(4)电解K2SO4溶液时,阳极附近OH-放电生成氧气,阴极附近是H+放电生成氢气,由于装置中放置了离子交换膜在两极分别生成KOH和H2SO4,需在阳极室一侧放置阴离子交换膜,允许通过的是阴离子,即SO42-和OH-,阴极室一侧放置阳离子交换膜,允许通过的是阳离子,即K+,H+,由于SO42-与K+的个数比为1 ∶2,故通过阴离子交换膜的离子比通过阳离子交换膜的少。
2NaOH+H2↑+Cl2↑;第二步:Cl2+2NaOH===NaCl+NaClO+H2O。将两步合并即得:NaCl+H2ONaClO+H2↑。(4)电解K2SO4溶液时,阳极附近OH-放电生成氧气,阴极附近是H+放电生成氢气,由于装置中放置了离子交换膜在两极分别生成KOH和H2SO4,需在阳极室一侧放置阴离子交换膜,允许通过的是阴离子,即SO42-和OH-,阴极室一侧放置阳离子交换膜,允许通过的是阳离子,即K+,H+,由于SO42-与K+的个数比为1 ∶2,故通过阴离子交换膜的离子比通过阳离子交换膜的少。

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目