题目内容
航天飞机常采用新型燃料电池作为电能来源,燃料电池可直接将化学能转化为电能。某电池以KOH溶液为电解质.其总反应的化学方程式为CH4+2O2+2OH- =CO32-+3H2O,根据题意回答下列问题:
(1)负极上的电极反应为_________________________________ 。
(2)消耗标准状况下5.6LO2时,有______mol电子发生转移。
(3)开始放电时,正极附近溶液的pH______(填“增大”“减小”或“不变”)
(1)负极上的电极反应为_________________________________ 。
(2)消耗标准状况下5.6LO2时,有______mol电子发生转移。
(3)开始放电时,正极附近溶液的pH______(填“增大”“减小”或“不变”)
CH4+10OH- _8e-=CO32-+7H2O 1 增大
(1)氧气在正极得电子发生还原反应:O2+4e-+2H2O=4OH-
(2)由总反应减去正极反应得负极反应为:CH4+10 OH- _8e-=CO3消耗标准状况下5.6LO2时,有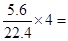 1mol电子转移
1mol电子转移
(3)正极反应O2+4e-+2H2O=4OH-生成了OH—,碱性增强,pH增大
(2)由总反应减去正极反应得负极反应为:CH4+10 OH- _8e-=CO3消耗标准状况下5.6LO2时,有
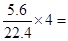 1mol电子转移
1mol电子转移(3)正极反应O2+4e-+2H2O=4OH-生成了OH—,碱性增强,pH增大

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
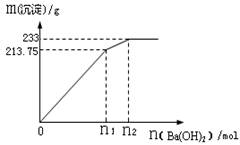
 CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据: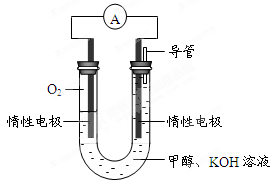


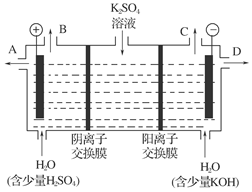

 收集到气体0.168 L(标况),若电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求A溶液的pH。
收集到气体0.168 L(标况),若电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求A溶液的pH。