题目内容
4. 碳是地球上含量丰富的元素,其氧化物的研究有着重要意义.
碳是地球上含量丰富的元素,其氧化物的研究有着重要意义.(1)如图是1mol NO2和1mol CO反应生成CO2和NO过 程中能量变化示意图,写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ/mol.
(2)试在原图基础上画出加入正催化剂后该反应在反应过程中的能量变化示意图(进行必要的标注).
(3)已知:N2(g)+O2(g)=2NO(g)△H=+180kJ/mol
2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746kJ/mol
写出一氧化碳气体燃烧热的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1.
(4)空气污染物一氧化碳的处理一直是科学研究的热点.某同学拟利用在催化剂作用下,CO分解生成无污染的物质,通过查阅文献发现:2CO(g)=2C(s,石墨)+O2(g)△H>0,△S<0;请你分析甲的思路否 (填是或否)可行?理由是该反应△G始终大于0,是非自发反应.
分析 (1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;
(2)加入催化剂,降低反应物的活化能,反应速率加快;
(3)依据盖斯定律和热化学方程式计算得到所需热化学方程式,注意燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
(4)依据反应自发碱性的判断依据分析判断,△H-T△S<0反应自发进行.
解答 解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ/mol,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ/mol;
(2)加入催化剂,降低反应物的活化能,反应速率加快,图象应为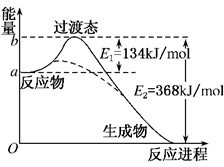 ,
,
故答案为:
(3)①N2(g)+O2(g)=2NO(g)△H=+180kJ/mol
②2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746kJ/mol
依据盖斯定律①+②得到2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol,
燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,则一氧化碳燃烧热的热化学方程式为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1,
故答案为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1;
(4)2CO(g)=2C(s,石墨)+O2(g)△H>0,△S<0,△G=△H-T△S>0,反应不能自发进行,不能实现此反应,
故答案为:否,该反应△G始终大于0,是非自发反应;
点评 本题考查反应热的有关计算以及催化剂对反应活化能的影响,反应自发进行的判断依据,题目难度中等,注意热化学方程式的计算以及加入催化剂,降低反应物的活化能.

 阅读快车系列答案
阅读快车系列答案| A. | 稀盐酸,Na2CO3溶液 | B. | 硫酸铝溶液,氨水 | ||
| C. | 碳酸氢钠溶液,澄清石灰水 | D. | 二氧化碳,氢氧化钠溶液 |
| A. | Na2O2放入水中 | B. | 电解饱和食盐水 | ||
| C. | 甲烷的燃烧 | D. | 盐酸滴定氢氧化钠溶液 |
①NH3的熔、沸点比ⅴA族相邻元素氢化物的熔、沸点高
②I2易溶于CCl4
③HF、HCl、HBr、HI的热稳定性依次减弱
④邻羟基苯甲酸的熔、沸点比对甲基苯甲酸的熔、沸点低
⑤水加热到很高的温度都难以分解
⑥CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
⑦水结成冰体积膨胀.
| A. | ①②④⑥⑦ | B. | ①④⑤⑦ | C. | ①④⑦ | D. | ②③⑦ |
| A. | NaOH | B. | Na2O | C. | FeCl2 | D. | CaO |
| A. | C2H4O和C3H6O均满足饱和一元醛的通式,因此它们一定互为同系物 | |
| B. | 乙烯和苯均可使溴水褪色,但是其褪色原理不同 | |
| C. | 乙烯和苯分子中各原子都在同一平面 | |
| D. | 检验乙烷中是否含有乙烯,试剂为酸性高锰酸钾溶液 |
| A. | 烃CnH2n+2 | B. | 醇CnH2n+2O | C. | 醛CnH2nO | D. | 羧酸CnH2nO2 |
(1)已知水存在如下平衡:H2O?H++OH-△H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是B.
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol•L-1]D.向水中加入NH4Cl固体
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填编号).
A.HCN B.HClOC.CH3COOHD.H2CO3
(3)实验室中常用NaOH来进行洗气和提纯.当400mL 1mol•L-1的NaOH溶液吸收标准状况
下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+).
(4)催化反硝化法可用于治理水中硝酸盐的污染.催化反硝化法中,H2能将NO3-还原为N2,25℃时,反应进行10min,溶液的pH由7变为12.
①N2的电子式为
 .
.②上述反应离子方程式为2NO3-+5H2$\frac{\underline{催化剂}}{△}$ N2+2OH-+4H2O,其平均反应速率v(NO3-)为0.001mol?L-1?min-1
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法加酸,升高温度,加水.