题目内容
10.A、B、C、D、E均为短周期元素,且原子序数依次递增.A、E同主族,B、D同周期,且B和D最外层电子数之和为10.A与D可形成A2D、A2D2共价化合物.请回答以下问题:(1)D位于周期表二周期,ⅥA族;
(2)E离子的结构示意图为
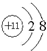 ;与E同周期的元素中,金属性最弱的金属元素名称是铝,所形成的最稳定的气态氢化物的化学式为HCl;
;与E同周期的元素中,金属性最弱的金属元素名称是铝,所形成的最稳定的气态氢化物的化学式为HCl;(3)C2的电子式为
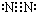 ,B与D通常能形成分子晶体,在E2D2中含有的化学键有离子键、共价键;
,B与D通常能形成分子晶体,在E2D2中含有的化学键有离子键、共价键;(4)由A、B、C、D四种元素组成的离子化合物的化学式为(写出一种即可)(NH4)2CO3,组成的共价化合物的结构简式为(写出一种即可)NH2-CH2-COOH.
分析 A、B、C、D、E均为短周期元素,且原子序数依次递增.A与D可形成A2D、A2D2共价化合物,则A为H元素、B为O元素;B、D同周期,且B和D最外层电子数之和为10,则B为碳元素;C的原子序数介于碳、氧之间,故C为N元素;A、E同主族,E的原子序数大于氧,故E为Na,据此解答.
解答 解:A、B、C、D、E均为短周期元素,且原子序数依次递增.A与D可形成A2D、A2D2共价化合物,则A为H元素、D为O元素;B、D同周期,且B和D最外层电子数之和为10,则B为碳元素;C的原子序数介于碳、氧之间,故C为N元素;A、E同主族,E的原子序数大于氧,故E为Na.
(1)D为O元素,位于周期表二周期ⅥA族,故答案为:二、ⅥA;
(2)E离子为Na+,Na+的结构示意图为 ;与E同周期的元素中,金属性最弱的金属元素名称是铝,所形成的最稳定的气态氢化物的化学式为HCl,
;与E同周期的元素中,金属性最弱的金属元素名称是铝,所形成的最稳定的气态氢化物的化学式为HCl,
故答案为: ;铝;HCl;
;铝;HCl;
(3)N2的电子式为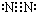 ,B与D通常能形成CO、CO2,属于分子晶体,在Na2O2中含有的化学键有:离子键、共价键,
,B与D通常能形成CO、CO2,属于分子晶体,在Na2O2中含有的化学键有:离子键、共价键,
故答案为: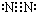 ;分子;离子键、共价键;
;分子;离子键、共价键;
(4)由H、C、N、O四种元素组成的离子化合物的化学式为(NH4)2CO3等,组成的共价化合物的结构简式为NH2-CH2-COOH等,
故答案为:(NH4)2CO3;NH2-CH2-COOH.
点评 本题考查结构性质位置关系综合应用,关键是推断元素,注意对基础知识的理解掌握.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
20.对下列图象的描述中,正确的
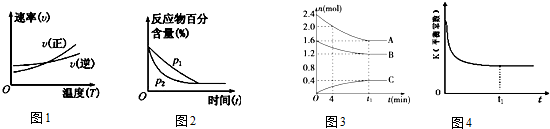 ( )
( )
 ( )
( )| A. | 根据图①可判断正反应的△H<0 | |
| B. | 图②可表示压强(p)对反应 2A(g)+2B(g)?3C(g)+D(s)的影响,P2 的压强大 | |
| C. | 图③可以表示的反应为 2A(g)+B(g)?C(g)△H<0 | |
| D. | 图④表示一定条件下,在绝热、恒容的密闭体系中进行的反应:NO(g)+NO2(g)?N2O3(g)△H<0,t1 时刻达到平衡状态 |
5.下列离子方程式中,正确的是( )
| A. | 碳酸钙与盐酸混合 2H++CO32-═CO2↑+H2O | |
| B. | 向氯化铁溶液中加入铁粉 Fe3++Fe═2Fe2+ | |
| C. | 亚硫酸钠溶液与稀硫酸混合 2H++SO32-═SO2↑+H2O | |
| D. | 二氧化锰与浓盐酸混合后加热 MnO2+4H++4Cl-═MnCl2+Cl2↑+2H2O |
15.下列物质中,不能同时与强酸、强碱溶液反应的是( )
| A. | NaHSO4 | B. | Al2O3 | C. | NaHCO3 | D. | Al(OH)3 |
20.在向500mL稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,放出N0气体6.72L(标准状况),同时溶液质量增加13.4g.下列判断正确的是( )
| A. | 原溶液中投入铁粉物质的量是0.25mo1 | |
| B. | 原溶液中HNO3的浓度是2.0mol•L-1 | |
| C. | 反应后的溶液中还可溶解9.6g铜 | |
| D. | 反应后的溶液中c(Fe2+):c(Fe3+)=3:1 |
 在100mL由HCl、AlCl3、MgCl2组成的混合溶液中,滴加5mol/L的NaOH溶液,产生白色沉淀的质量与加入NaOH溶液的体积之间的关系如图所示.
在100mL由HCl、AlCl3、MgCl2组成的混合溶液中,滴加5mol/L的NaOH溶液,产生白色沉淀的质量与加入NaOH溶液的体积之间的关系如图所示.