题目内容
20.对下列图象的描述中,正确的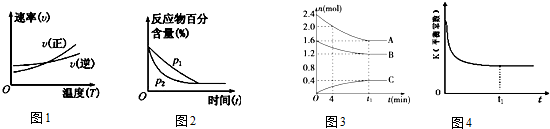 ( )
( )| A. | 根据图①可判断正反应的△H<0 | |
| B. | 图②可表示压强(p)对反应 2A(g)+2B(g)?3C(g)+D(s)的影响,P2 的压强大 | |
| C. | 图③可以表示的反应为 2A(g)+B(g)?C(g)△H<0 | |
| D. | 图④表示一定条件下,在绝热、恒容的密闭体系中进行的反应:NO(g)+NO2(g)?N2O3(g)△H<0,t1 时刻达到平衡状态 |
分析 A、图象分析可知开始逆反应速率大于正反应速率,达到平衡后,继续升温正反应速率大于逆反应速率,平衡正向进行;
B、先拐先平压强大,压强越大平衡正向进行,反应物百分含量减小;
C、图象分析可知,AB物质的量减小为反应物,C物质的量增加为生成物,物质反应的物质的量之比等于化学方程式计量数之比,据此写出化学方程式;
D、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响.
解答 解:A、图象分析可知开始逆反应速率大于正反应速率,达到平衡后,继续升温正反应速率大于逆反应速率,平衡正向进行,正反应的△H>0,故A错误;
B、先拐先平压强大,P2 的压强大,反应是气体体积减小的反应,压强越大平衡正向进行,反应物百分含量减小,平衡状态反应物含量不同,图象不符合,故B错误;
C、图象分析可知,AB物质的量减小为反应物,C物质的量增加为生成物,A物质的量减小2.4mol-1.6mol=0.8mol,B物质的量减小=1.6mol-1.2mol=0.4mol,C生成物质的量=0.4mol,物质反应的物质的量之比等于化学方程式计量数之比n(A):n(B):n(C)=0.8:0.4:0.4=2:1:1,化学方程式为A(g)+B(g)?C(g),但反应的焓变无法判断,故C错误;
D、该反应在绝热、恒容的密闭体系中进行,反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故D正确;
故选D.
点评 本题考查化学平衡图象、影响化学平衡的因素等,题目综合性较大,难度中等,是对知识的综合利用,注意基础知识的理解掌握.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
11.对胶体的下列叙述不正确的是( )
| A. | 加电解质可使某种胶体聚沉,这是中和胶体粒子所带电荷的缘故 | |
| B. | 胶体粒子在直流电场中做定向移动,这是胶体粒子选择性吸附离子而带电荷的缘故 | |
| C. | 一束光线通过胶体时有丁达尔效应,这是胶体粒子对光散射的缘故 | |
| D. | 由于胶体粒子带电荷,所以胶体这种分散系不是电中性的 |
8.下列反应的离子方程式正确的是( )
| A. | H2S通入CuSO4溶液中 S2-+Cu2+=CuS↓ | |
| B. | AgCl投入KI溶液中 Ag++I-=AgI↓ | |
| C. | Na2S的水解反应 S2-+2H2O?H2S+2OH- | |
| D. | NH4NO3溶液呈酸性 NH4++H2O?NH3•H2O+H+ |
15.下列说法正确的是( )
| A. | 在 101kPa 下,1克物质燃烧所放出的热量叫做该物质的热值 | |
| B. | 金属的防腐处理中,牺牲阳极的阴极保护法是电解池原理的应用 | |
| C. | 活化分子间的碰撞就是有效碰撞 | |
| D. | 催化剂能增大单位体积内活化分子百分数,从而增大反应速率 |
12.高中化学学习过程中的物质颜色是需要注意的.下列关于颜色的描述正确的个数是( )
①氯水放久了会逐渐由黄绿色变成几乎无色
②AgBr见光分解会生成银白色的银
③KI溶液中加入淀粉溶液会变成紫色
④碘水中加入CCl4振荡静置后,下层紫红色
⑤钠在氯气中燃烧火焰为黄色.
①氯水放久了会逐渐由黄绿色变成几乎无色
②AgBr见光分解会生成银白色的银
③KI溶液中加入淀粉溶液会变成紫色
④碘水中加入CCl4振荡静置后,下层紫红色
⑤钠在氯气中燃烧火焰为黄色.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
9.下列变化规律正确的是( )
| A. | 半径:Li>Na>K>Rb | |
| B. | 酸性:HClO4>H2SO4>H3PO4>H2CO3 | |
| C. | 气态氢化物的稳定性:HI>HBr>HCl>HF | |
| D. | 还原性:Cl->Br->I->S2- |
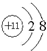 ;与E同周期的元素中,金属性最弱的金属元素名称是铝,所形成的最稳定的气态氢化物的化学式为HCl;
;与E同周期的元素中,金属性最弱的金属元素名称是铝,所形成的最稳定的气态氢化物的化学式为HCl;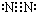 ,B与D通常能形成分子晶体,在E2D2中含有的化学键有离子键、共价键;
,B与D通常能形成分子晶体,在E2D2中含有的化学键有离子键、共价键;