题目内容
1.标准状况下,用一定量的水吸收氨气后制得溶液(密度为0.915g•cm-3).该溶液中氨水的物质的量浓度为12.0mol/L,试计算:(1)该氨水中NH3的质量分数为22.3%.
(2)1体积水需吸收378体积氨气(标准状况)可制得上述氨水
(3)取a/5mL的上述氨水,稀释到5a mL,所得溶液中氨水的物质的量浓度约为0.48mol/L.(本题中氨水稀释过程中的其它变化忽略不计,水的密度以1.00g•cm-3计)
分析 (1)根据c=$\frac{1000ρω}{M}$进行计算;
(2)设氨气体积为VL,则水为1L,根据n=$\frac{V}{{V}_{m}}$计算氨气物质的量,根据m=nM计算氨气质量,根据m=ρV计算水的质量,溶液质量=水的质量+氨气质量,根据V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算;
(3)根据稀释定律计算.
解答 解:(1)根据c=$\frac{1000ρω}{M}$可知,密度为0.915g•cm-3、物质的量浓度为12.0mol/L的氨水溶液中中NH3的质量分数为$\frac{12×17}{1000×0.915}$=22.3%,故答案为:22.3%;
(2)设氨气体积为VL,则水为1L,氨气物质的量为$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,氨气质量为$\frac{17V}{22.4}$g,水的质量为1000mL×1g/mL=1000g,溶液质量=(1000+$\frac{17V}{22.4}$)g,溶液体积=$\frac{(1000+\frac{17V}{22.4})g}{915g/L}$,则$\frac{(1000+\frac{17V}{22.4})g}{915g/L}$×12mol/L=$\frac{V}{22.4}$mol,解得V=378,故答案为:378;
(3)取$\frac{a}{5}$mL的上述氨水,稀释到5a mL,根据稀释定律,稀释后所得溶液中氨水的物质的量浓度约为 $\frac{\frac{a}{5}mL×12mol/L}{5amL}$=0.48mol/L,故答案为:0.48mol/L.
点评 本题考查溶液浓度计算,涉及质量分数、物质的量浓度,注意掌握质量分数与物质的量浓度之间关系.

| A. | 加电解质可使某种胶体聚沉,这是中和胶体粒子所带电荷的缘故 | |
| B. | 胶体粒子在直流电场中做定向移动,这是胶体粒子选择性吸附离子而带电荷的缘故 | |
| C. | 一束光线通过胶体时有丁达尔效应,这是胶体粒子对光散射的缘故 | |
| D. | 由于胶体粒子带电荷,所以胶体这种分散系不是电中性的 |
①氯水放久了会逐渐由黄绿色变成几乎无色
②AgBr见光分解会生成银白色的银
③KI溶液中加入淀粉溶液会变成紫色
④碘水中加入CCl4振荡静置后,下层紫红色
⑤钠在氯气中燃烧火焰为黄色.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
| A. | 半径:Li>Na>K>Rb | |
| B. | 酸性:HClO4>H2SO4>H3PO4>H2CO3 | |
| C. | 气态氢化物的稳定性:HI>HBr>HCl>HF | |
| D. | 还原性:Cl->Br->I->S2- |
| A. | 常温常压下,48gO2跟48gO3 含有的氧原子数均为3NA | |
| B. | 1L 0.5mol/L的(NH4)2SO4溶液中含有NH4+数目为NA | |
| C. | 标准状况下,11.2L 氨气所含有的原子数是4NA | |
| D. | 80gNaOH溶解在1 L水中,得到溶液的物质的量浓度为2mol/L |
| A. | H2O | B. | CaO(s) | C. | CaCO3 (s) | D. | NaOH (s) |
| A. | c (Cl-)>c (NH4+)>c (OH-)>c (H+) | B. | c (Cl-)>c (NH4+)>c (H+)>c (OH-) | ||
| C. | c (H+)>c (OH-)>c (Cl-)>c (NH4+) | D. | c (H+)>c (Cl-)>c (NH4+)>c (OH-) |
| A. | 利用太阳能、潮汐能、风力发电,可以获取清洁能源 | |
| B. | 利用可降解的“玉米塑料”生产一次性饭盒,可防止白色污染 | |
| C. | 化学药品着火,都要立即用水或泡沫灭火器灭火 | |
| D. | 采用纳米二氧化钛光触媒技术可将汽车尾气中的NO和CO转化为无害气体 |
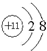 ;与E同周期的元素中,金属性最弱的金属元素名称是铝,所形成的最稳定的气态氢化物的化学式为HCl;
;与E同周期的元素中,金属性最弱的金属元素名称是铝,所形成的最稳定的气态氢化物的化学式为HCl;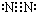 ,B与D通常能形成分子晶体,在E2D2中含有的化学键有离子键、共价键;
,B与D通常能形成分子晶体,在E2D2中含有的化学键有离子键、共价键;