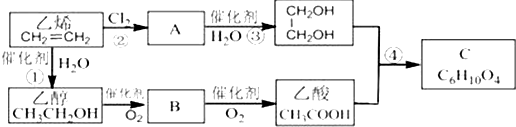
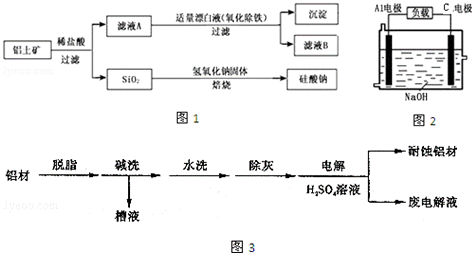
题目内容
20.在向500mL稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,放出N0气体6.72L(标准状况),同时溶液质量增加13.4g.下列判断正确的是( )| A. | 原溶液中投入铁粉物质的量是0.25mo1 | |
| B. | 原溶液中HNO3的浓度是2.0mol•L-1 | |
| C. | 反应后的溶液中还可溶解9.6g铜 | |
| D. | 反应后的溶液中c(Fe2+):c(Fe3+)=3:1 |
分析 A.生成NO的物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,溶液质量增重为参加反应Fe的质量与生成NO的质量之差,则n(Fe)×56g/mol-0.3mol×30g/mol=13.4g,解得n(Fe)=0.4mol;
B.根据电子转移守恒,可知生成物中Fe元素平均化合价为$\frac{0.3mol×(5-2)}{0.4mol}$=2.25,故反应生成Fe2+、Fe3+,硝酸完全反应,设Fe2+、Fe3+的物质的量分别为xmol、ymol,根据二者总物质的量、电子转移守恒列方程计算,再根据N元素守恒:n(HNO3)=2n[Fe(NO3)2]+3n[Fe(NO3)3]+n(NO);
C.根据2Fe3++Cu=2Fe2++Cu2+计算溶解Cu的质量;
D.根据B中计算数据可得溶液中c(Fe2+):c(Fe3+).
解答 解:A.生成NO的物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,溶液质量增重为参加反应Fe的质量与生成NO的质量之差,则n(Fe)×56g/mol-0.3mol×30g/mol=13.4g,解得n(Fe)=0.4mol,故A错误;
B.根据电子转移守恒,可知生成物中Fe元素平均化合价为$\frac{0.3mol×(5-2)}{0.4mol}$=2.25,故反应生成Fe2+、Fe3+,硝酸完全反应,设Fe2+、Fe3+的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.4}\\{2x+3y=0.3×3}\end{array}\right.$
解得x=0.3,y=0.1,
根据N元素守恒:n(HNO3)=2n[Fe(NO3)2]+3n[Fe(NO3)3]+n(NO)=0.3mol×2+0.1mol×3+0.3mol=1.2mol,故c(HNO3)=$\frac{1.2mol}{0.5L}$=2.4mol/L,故B错误;
C.根据2Fe3++Cu=2Fe2++Cu2+,可知溶解Cu为0.1mol×$\frac{1}{2}$=0.05mol,故溶解Cu的质量为0.05mol×64g/mol=3.2g,故C错误;
D.根据B中计算可知溶液中c(Fe2+):c(Fe3+)=0.3mol:0.1mol=3:1,故D正确,
故选:D.
点评 本题考查氧化还原反应的计算,侧重于学生的分析能力和计算能力的考查,注意利用电子转移守恒计算,难度中等.

 每课必练系列答案
每课必练系列答案| A. | 利用太阳能、潮汐能、风力发电,可以获取清洁能源 | |
| B. | 利用可降解的“玉米塑料”生产一次性饭盒,可防止白色污染 | |
| C. | 化学药品着火,都要立即用水或泡沫灭火器灭火 | |
| D. | 采用纳米二氧化钛光触媒技术可将汽车尾气中的NO和CO转化为无害气体 |
| A. | C22-的电子式是[ ]2- ]2- | |
| B. | Mg2C3和Li2C2与水反应生成的烃可能具有相同的官能团 | |
| C. | 1mol ZnC2与水反应生成的烃的体积约为22.4L | |
| D. | Al4C3与水反应生成的烃分子中只有极性键 |
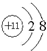 ;与E同周期的元素中,金属性最弱的金属元素名称是铝,所形成的最稳定的气态氢化物的化学式为HCl;
;与E同周期的元素中,金属性最弱的金属元素名称是铝,所形成的最稳定的气态氢化物的化学式为HCl;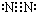 ,B与D通常能形成分子晶体,在E2D2中含有的化学键有离子键、共价键;
,B与D通常能形成分子晶体,在E2D2中含有的化学键有离子键、共价键;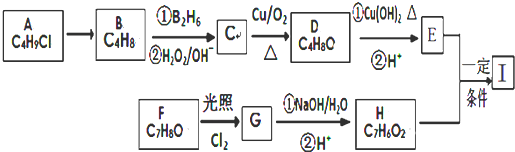
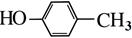 ;
;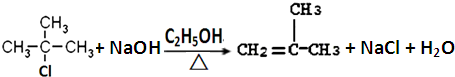 ;
;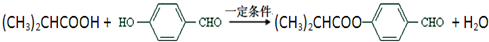 ;
;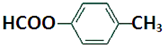 .
.