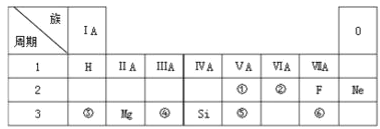
题目内容
【题目】钛被誉为第三金属,广泛用于航空航天领域。硼化钒(VB2)—空气电池的放电反应为4VB2+11O2=4B2O3+2V2O5,以该电池为电源制备钛的装置如图所示,下列说法正确的是( )
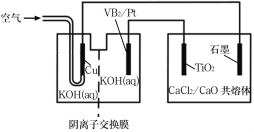
A.电解过程中,OH-由阴离子交换膜右侧向左侧迁移
B.Pt极反应式为2VB2+22OH--22e-=V2O5+2B2O3+11H2O
C.电解过程中,铜极附近电解质溶液的pH增大
D.若石墨电极上只收集到4.48L气体,则理论上制备4.8gTi
【答案】BC
【解析】
根据总反应,VB2发生氧化反应,所以Pt是负极,O2发生还原反应,Cu是正极;则石墨电极是阳极、TiO2是阴极。
A. Pt是负极,原电池中阴离子移向负极,OH-由阴离子交换膜左侧向右侧迁移,A错误;
B. Pt是负极,VB2发生氧化反应,负极反应式为:2VB2-22e-+22OH-=V2O5+2B2O3+11H2O, B正确;
C. 铜是正极,正极反应为:O2+2H2O+4e-=4OH-,正极生成OH-,铜极附近电解质溶液pH增大,C正确;
D. 未指明气体是否处于“标准状况”,无法计算,D错误;
故答案为:BC。

练习册系列答案
相关题目