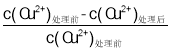题目内容
【题目】重铬酸钠晶体(Na2Cr2O7·2H2O)俗称红矾钠,是一种重要的化工产品,以FeO·Cr2O3、Na2CO3等为原料制备红矾钠的工艺如图所示。
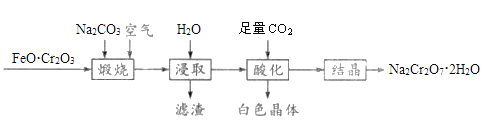
回答下列问题:
(1)FeO·Cr2O3中Cr的化合价是__________。
(2)写出“煅烧”过程发生反应的化学方程式________________________。
(3)滤渣的主要成分为________(填化学式)。
(4)“酸化”过程中发生反应的离子方程式为_____________________________,加入硫酸也能达到“酸化”目的,选择CO2的优点是__________________________________。
(5)称取红矾钠样品1.8000g配成250mL溶液,量取20.00mL于碘量瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钾溶液(铬的还原产物为Cr3+),放于暗处5min,加入淀粉溶液作指示剂,用0.1000moL·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),判断达到滴定终点的现象是______________________________。若实验中平均消耗Na2S2O3标准溶液25.00mL,则重铬酸钠晶体的纯度为______________(设整个过程中其他杂质不参与反应,结果保留4位有效数字)
【答案】+3 4FeO·Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2 Fe2O3 2Na++2CrO42-+2CO2+H2O=Cr2O72-+2NaHCO3↓ 析出的白色晶体碳酸氢钠加热后产生的Na2CO3、CO2能循环利用 滴入最后一滴Na2S2O3溶液时,溶液由蓝色变为无色且半分钟内不恢复原色 86.23%
【解析】
制备重铬酸盐,往往需要先制得铬酸盐,在将铬酸盐酸化制得重铬酸盐:![]() 。
。
(1)FeO·Cr2O3中,氧化物可以看成是独立存在的个体,根据化合物中各元素化合价代数和为零可求得,Fe呈+2价,Cr呈+3价,O呈-2价;
(2)Na2Cr2O7·2H2O中Cr为+6价,根据流程可知FeO·Cr2O3与空气、Na2CO3煅烧后(Cr的化合价从+3价升高为+6价,Fe由+2价升高到+3价),可知生成了 Na2CrO4、Fe2O3,根据化合价升降守恒配平化学方程式:4FeO·Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2;
(3)由(2)中方程式产物可知滤渣为Fe2O3;
(4)在Na2CrO4溶液中通入CO2,生成Na2Cr2O7,白色晶体 NaHCO3,其离子方程式为:2Na++2CrO42-+2CO2+H2O=Cr2O72-+2NaHCO3↓; NaHCO3受热分解产生Na2CO3、CO2,二者都能循环利用,故选择CO2酸化更能充分利用物质;
(5)涉及的离子方程式有Cr2O72-+ 6I-+14H+=2Cr3++3I2+7H2O、且I2+2S2O3 2-=S4O62-+2I-,达到滴定终点时,滴入最后一滴Na2S2O3标准溶液,溶液由蓝色变为无色且半分钟内不恢复原色;由上述方程式可得关系式Cr2O72--3I2-6S2O32-,n(S2O32-)=25.00×10-3L×0.1000mol·L-1=2.5×10-3mol,
Cr2O72--3I2-6S2O32-
1 6
n(Cr2O72-)2 2.5×10-3mol
则n(Cr2O72-)2=2.5×10-3mol÷6=![]() ×10-3mol,所以在250mL的溶液中,n(Cr2O72-)1=
×10-3mol,所以在250mL的溶液中,n(Cr2O72-)1=![]() ×10-3mol×250mL÷20mL=
×10-3mol×250mL÷20mL=![]() ×10-3mol,则w(Na2Cr2O7·2H2O)=
×10-3mol,则w(Na2Cr2O7·2H2O)=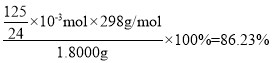
则重铬酸钠晶体的纯度为86.23%

【题目】用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
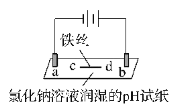
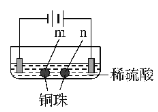
现象 | a 、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近均有气泡产生;铜珠n的右侧有气泡产生。 |
下列对实验现象的解释或推测不合理的是( )
A. 根据实验一的原理,实验二中铜珠m左侧变厚
B. a、d处:2H2O+2e-=H2↑+2OH-
C. b处:2Cl--2e-=Cl2↑;Cl2 + H2O =HCl + HClO
D. c处发生了反应:Fe-2e-=Fe2+
【题目】I.下面列出了几组物质,请用物质的组号填写下表。
类型 | 同位素 | 同素异形体 | 同分异构体 | 同系物 |
组号 | __ | __ | __ | __ |
① ![]() 与
与![]() ②
② ![]() 与
与![]() ③金刚石和石墨 ④12C、13C、14C ⑤
③金刚石和石墨 ④12C、13C、14C ⑤![]() 和
和![]()
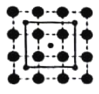
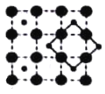
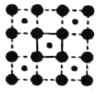
II.下图中A、B、C 分别是三种烃的结构模型:

请回答下列问题:
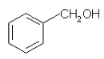
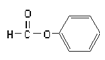
(1)A 的电子式______________,B 的结构简式________________。
(2)A及其同系物的分子式符合通式_____________(用 n 表示)。当 n=____________时,烷烃开始出现同分异构体;当 n=6 时,同分异构体有__________种。
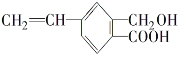
(3)A、B、C 三种有机物中,所有原子均共面的是___________(填名称)。结构简式为 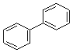 的有机物中,处于同一平面内的原子数最多为__________,处于 同一平面内的碳原子数至少为____________。
的有机物中,处于同一平面内的原子数最多为__________,处于 同一平面内的碳原子数至少为____________。
(4)有机物 C 不具有的结构或性质是_____________(填字母序号)。
a.是碳碳双键和碳碳单键交替的结构 b.有毒、不溶于水、密度比水小
c.不能使酸性 KMnO4 溶液和溴水反应褪色 d.一定条件下能与氢气或氧气反应
(5)等质量的三种有机物完全燃烧生成 H2O 和 CO2,消耗氧气的体积(相同状况下)最大的是_______(填A 或B 或 C)。
III.某有机物的结构简式如图,1mol 该有机物最多可以和______mol氢气反应,最多可以和_____molNaOH 反应。