题目内容
【题目】工业上将石灰石和硫煤混合使用,称之为“固硫”,其反应原理为:2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) △H1=akJ·mol-1。
2CaSO4(s)+2CO2(g) △H1=akJ·mol-1。
已知:CaO(s)+CO2(g)![]() CaCO3(s) △H2=bkJ·mol-1;
CaCO3(s) △H2=bkJ·mol-1;
2SO2(g)+O2(g)![]() 2SO3(g) △H3=ckJ·mol-1。
2SO3(g) △H3=ckJ·mol-1。
请回答下列问题:
(1)CaSO4(s)![]() CaO(s)+SO3(g)△H=___kJ·mol-1(用a、b、c表示)。
CaO(s)+SO3(g)△H=___kJ·mol-1(用a、b、c表示)。
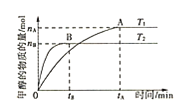
(2)T1℃时,向某恒容密闭容器中通入一定量的CO2和足量CaO发生反应:CaO(s)+CO2(g)![]() CaCO3(s),CO2的浓度随时间变化如图所示:
CaCO3(s),CO2的浓度随时间变化如图所示:
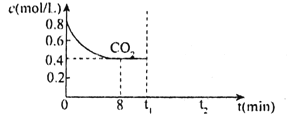
①0~8min,v(CO2)=___。
②t1min时,若保持其他条件不变,压缩容器体积至原来的![]() ,t2min重新达到平衡,请在图中画出CO2的浓度自条件改变至新平衡的变化曲线___。
,t2min重新达到平衡,请在图中画出CO2的浓度自条件改变至新平衡的变化曲线___。
(3)T2℃时,向某密闭容器中通入2molSO2和1molO2发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H3=ckJ·mol-1。
2SO3(g) △H3=ckJ·mol-1。
①若该容器为恒压密闭容器,下列选项可判断反应已达平衡状态的是___。
A.混合气体的密度不再改变
B混合气体的压强不再改变
C.相同时间内,每断裂0.1molO=O键,同时生成0.2molSO3
D.混合气体的平均相对分子质量不再改变
②若该容器为2L的恒容密闭容器,达平衡时SO3的体积分数为40%,则O2的转化率为___,T2℃时该反应的平衡常数K=___。
③反应达到②中的平衡状态后,保持反应温度和O2的浓度不变,增大容器体积,则平衡将___(填“正向”、“逆向”或“不“)移动,原因为___。
【答案】![]() 0.05mol·L-1·min-1
0.05mol·L-1·min-1  AD 50% 4 不
AD 50% 4 不 ![]() ,保持O2浓度不变,扩大容器体积,SO2、SO3浓度同等程度的减小,则Qc=K,平衡不移动
,保持O2浓度不变,扩大容器体积,SO2、SO3浓度同等程度的减小,则Qc=K,平衡不移动
【解析】
(1)巳知反应①2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g)△H1=akJ·mol-1;
2CaSO4(s)+2CO2(g)△H1=akJ·mol-1;
②CaO(s)+CO2(g)![]() CaCO3(s) △H2=bkJ·mol-1;
CaCO3(s) △H2=bkJ·mol-1;
③2SO2(g)+O2(g)![]() 2SO3(g) △H3=ckJ·mol-1。
2SO3(g) △H3=ckJ·mol-1。
结合盖斯定律:![]() ×③-②-
×③-②-![]() ×①可得反应CaSO4(s)
×①可得反应CaSO4(s)![]() CaO(s)+SO3(g),则△H=
CaO(s)+SO3(g),则△H=![]() ×③-②-
×③-②-![]() ×①=
×①=![]() ×c-b-
×c-b-![]() ×a=
×a=![]() ;
;
(2)①CO2的浓度从0.8mol·L-1降低到0.4mol·L-1,变化了0.4mol·L-1,则![]() ;
;
②压缩体积至原来的![]() 的瞬间CO2的浓度增加一倍,从0.4mol·L-1变成0.8mol·L-1,该反应的平衡常数为
的瞬间CO2的浓度增加一倍,从0.4mol·L-1变成0.8mol·L-1,该反应的平衡常数为![]() ,温度不变,平衡常数不变,则CO2的浓度不变,达到新的平衡时CO2的浓度仍为0
,温度不变,平衡常数不变,则CO2的浓度不变,达到新的平衡时CO2的浓度仍为0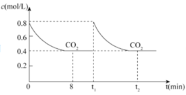 ;
;
(3)①A.该反应为气体分子数改变的反应,且该容器为恒压密闭容器,则反应过程中体积改变,气体质量不变,则气体密度会发生变化,则混合气体的密度不再改变可以说明平衡,A正确;
B.该容器为恒压密闭容器,体系压强恒定,则混合气体的压强不再改变不能说明平衡状态,B错误;
C.相同时间内,每断裂0.1molO=O键,同时生成0.2molSO3的反应方向相同,不能说明平衡状态,C错误;
D.该反应气体质量不变,但气体物质的量改变,则平均相对分子质量为变化值,则混合气体的平均相对分子质量不再改变可以说明平衡状态,D正确;
答案为:AD;
②利用三等式求转化率和平衡常数,设O2转化了xmol,有

平衡时,SO3的体积分数为40%,有![]() ,得x=0.5,则O2的转化率
,得x=0.5,则O2的转化率![]() ;容器的体积为2L,则平衡常数
;容器的体积为2L,则平衡常数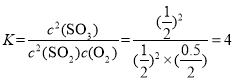 ;
;
③因为平衡常数![]() ,保持O2浓度不变,且原平衡c(SO3)=c(SO2),扩大容器体积,SO2、SO3浓度同等程度的减小,
,保持O2浓度不变,且原平衡c(SO3)=c(SO2),扩大容器体积,SO2、SO3浓度同等程度的减小,![]() 不变,则Qc=K,平衡不移动。答案:不
不变,则Qc=K,平衡不移动。答案:不
![]() ,保持O2浓度不变,扩大容器体积,SO2、SO3浓度同等程度的减小,则Qc=K,平衡不移动。
,保持O2浓度不变,扩大容器体积,SO2、SO3浓度同等程度的减小,则Qc=K,平衡不移动。