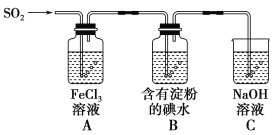
题目内容
【题目】常温下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
B. c(H+)/c(OH﹣) =1×10-12的溶液中:K+、Na+、![]() 、
、![]()
C. c(Fe2+)=1 molL-1的溶液中:K+、![]() 、
、![]() 、
、![]()
D. 能使甲基橙变红的溶液中:Na+、![]() 、
、![]() 、
、![]()
【答案】B
【解析】
A、无色溶液中不含Fe3+,且Fe3+与SCN–会发生络合反应而不能大量共存,选项A错误;B、使PH试纸变蓝的溶液呈碱性,氢氧根离子和K+、Na+、![]() 、
、![]() 都彼此不反应,能大量共存,选项B正确;C、c(Fe2+) =1 mol·L-1的溶液中,亚铁离子会与高锰酸根离子发生氧化还原反应而不能大量共存,选项C错误;D、能使石蕊试液变红的溶液呈酸性, 弱酸根离子碳酸氢根离子不能大量存在,选项D错误。答案选B。
都彼此不反应,能大量共存,选项B正确;C、c(Fe2+) =1 mol·L-1的溶液中,亚铁离子会与高锰酸根离子发生氧化还原反应而不能大量共存,选项C错误;D、能使石蕊试液变红的溶液呈酸性, 弱酸根离子碳酸氢根离子不能大量存在,选项D错误。答案选B。

 阅读快车系列答案
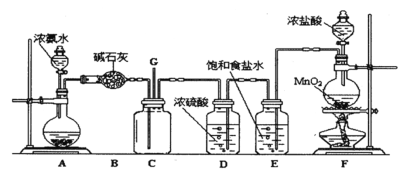
阅读快车系列答案【题目】某实验小组为了探究铝与盐酸反应过程中的速率变化,分两组做了以下实验。
(1)甲小组同学用足量的铝与50 mL盐酸发生反应,并用排水集气法收集反应放出的氢气,实验记录如下:
时间/min | 1 | 2 | 3 | 4 | 5 | 反应结束时 |
氢气体积/mL(标准状况下) | 50 | 150 | 300 | 380 | 410 | 560 |
①哪一时间段(即0~1、1~2、2~3、3~4、4~5 min)反应速率最大__,原因是____;
②反应进行到10 min时,便不再有气泡产生,该盐酸中HCl的物质的量浓度是__,整个反应过程中HCl的反应速率为____;
(2)乙小组学生也做了同样的实验,但由于反应太快,不好测量氢气体积,他事先在盐酸中加入等体积的下列液体:A.蒸馏水、B.KCl溶液、C.KNO3溶液、D.CuSO4溶液,以减慢反应速率,你认为可行的是____,不可行的理由是_________。
【题目】I.工业上可由氢气、氮气合成氨气,溶于水形成氨水。盐酸和氨水是实验室常见的电解质溶液。一定温度下,向2L 密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。
2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。
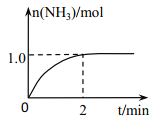
(1)0~2 min 内的平均反应速率 v(H2)=___________。
(2)该温度下,反应 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
T/ ℃ | 25 | 125 | 225 |
平衡常数 K | 4×106 | K1 | K2 |
试判断K1________K2(填写“>”“=”或“<”)。
(3)下列能说明合成氨反应已达到平衡状态的是______(填字母)(反应是在固定体积的密闭容器中进行的)
a.3v(N2) = v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
II.常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH 如下表。
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液 pH |
① | 0. 2 | 0.2 | pH=x |
② | c | 0.2 | pH=7 |
请回答:
(4)①中所得混合溶液, pH_______7(填“>”“<”或“=”)。
②中 c___0.2(填“>”“<”或“=”),所得混合溶液中各离子浓度大小关系为_____________。
(5)请你再设计一个能证明一水合氨是弱电解质的方案。_____________。
【答案】 0.375 mol/(L·min) [NH3]2/[N2][H2]3 > bd < > [Cl-]= [NH4+]> [H+]= [OH-] 测量 0.1mol/L 氨水的 pH,pH小于13 等
【解析】试题分析:I.(1)根据![]() 计算反应速率;(2)根据平衡常数的定义书写平衡常数表达式;反应 N2(g)+3H2(g)
计算反应速率;(2)根据平衡常数的定义书写平衡常数表达式;反应 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)正反应放热,升高温度平衡逆向移动;(3)根据平衡状态的特征分析;II. (4)①等浓度、等体积的盐酸和氨水混合,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解;②若等浓度、等体积的盐酸和氨水混合,溶液呈酸性,要使pH=7,则氨水的物质的量大于盐酸;根据电荷守恒分析离子浓度关系;(5)根据弱电解质部分电离或弱碱阳离子能水解设计方案;
2NH3(g)+ Q(Q>0)正反应放热,升高温度平衡逆向移动;(3)根据平衡状态的特征分析;II. (4)①等浓度、等体积的盐酸和氨水混合,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解;②若等浓度、等体积的盐酸和氨水混合,溶液呈酸性,要使pH=7,则氨水的物质的量大于盐酸;根据电荷守恒分析离子浓度关系;(5)根据弱电解质部分电离或弱碱阳离子能水解设计方案;
解析:I.(1)2min内生成1mol氨气,则消耗氢气1.5mol, ![]() =
=![]() 0.375 mol/(L·min);(2)根据平衡常数的定义,平衡常数K=
0.375 mol/(L·min);(2)根据平衡常数的定义,平衡常数K=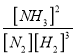 ;反应 N2(g)+3H2(g)
;反应 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)正反应放热,升高温度平衡逆向移动,平衡常数减小,所以K1>K2;(3)a.任意时刻速率比都等于系数比,所以3v(N2) = v(H2)不一定平衡,故a错误; b.N2(g)+3H2(g)
2NH3(g)+ Q(Q>0)正反应放热,升高温度平衡逆向移动,平衡常数减小,所以K1>K2;(3)a.任意时刻速率比都等于系数比,所以3v(N2) = v(H2)不一定平衡,故a错误; b.N2(g)+3H2(g)![]() 2NH3(g),气体物质的量是变量,所以压强是变量,容器内压强保持不变一定达到平衡状态,故b正确;c.根据
2NH3(g),气体物质的量是变量,所以压强是变量,容器内压强保持不变一定达到平衡状态,故b正确;c.根据![]() ,气体密度是恒量, 混合气体的密度保持不变不一定平衡,故c错误;d.25℃时K=4×106,容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1,
,气体密度是恒量, 混合气体的密度保持不变不一定平衡,故c错误;d.25℃时K=4×106,容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1, 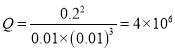 ,Q=K,反应一定达到平衡状态,故d正确。
,Q=K,反应一定达到平衡状态,故d正确。
II. (4)①等浓度、等体积的盐酸和氨水混合,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解![]() ,所以溶液呈酸性pH<7;②若等浓度、等体积的盐酸和氨水混合,溶液呈酸性,要使pH=7,则氨水的物质的量大于盐酸,所以c>0.2;根据电荷守恒,[Cl-]+[OH-]= [NH4+]+ [H+],溶液呈中性,[OH-]= [H+],所以离子浓度关系为[Cl-]= [NH4+]> [H+]= [OH-];(5)测量 0.1mol/L 氨水的 pH,pH小于13 ,能证明一水合氨部分电离是弱电解质;
,所以溶液呈酸性pH<7;②若等浓度、等体积的盐酸和氨水混合,溶液呈酸性,要使pH=7,则氨水的物质的量大于盐酸,所以c>0.2;根据电荷守恒,[Cl-]+[OH-]= [NH4+]+ [H+],溶液呈中性,[OH-]= [H+],所以离子浓度关系为[Cl-]= [NH4+]> [H+]= [OH-];(5)测量 0.1mol/L 氨水的 pH,pH小于13 ,能证明一水合氨部分电离是弱电解质;
点睛:同浓度、同体积的一元强酸与一元弱碱混合,溶液呈酸性;同浓度、同体积的一元弱酸与一元强碱混合,溶液呈碱性;同浓度、同体积的一元强酸与一元强碱混合,溶液呈中性。
【题型】综合题
【结束】
23
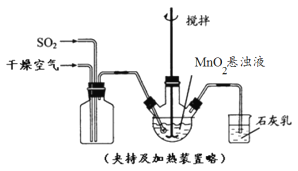
【题目】为了探究铁、铜及其化合物的性质,某同学设计并进行了下列两组实验。
实验一:
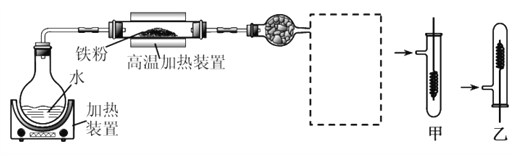
已知:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
(1)虚线框处宜选择的装置是________(填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是______________________。
(2)实验后,为检验硬质玻璃管中的固体是否含+3价的铁元素,该同学取一定量的固体并用一定浓度的盐酸溶解,滴加_______溶液(填试剂名称或化学式),没有出现血红色,说明该固体中没有+3价的铁元素。请你判断该同学的结论是否正确并说明理由_________________。
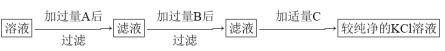
实验二:
绿矾是含有一定量结晶水的硫酸亚铁,为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A 称重,记为m2 g,B为干燥管。按下图连接好装置进行实验。
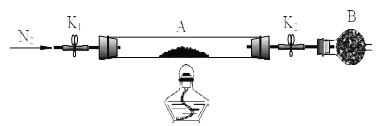
实验步骤如下:(1)________,(2)点燃酒精灯,加热,(3)______,(4)______,(5)______,
(6)称量A, 重复上述操作步骤,直至 A 恒重,记为m3 g。
(3)请将下列实验步骤的编号填写在对应步骤的横线上
a.关闭 K1 和 K2 b.熄灭酒精灯 c.打开 K1 和 K2 缓缓通入 N2 d.冷却至室温
(4)必须要进行恒重操作的原因是_________________。
(5)已知在上述实验条件下,绿矾受热只是失去结晶水,硫酸亚铁本身不会分解, 根据实验记录,
计算绿矾化学式中结晶水数目 x=__________________(用含 m1、 m2、 m3的列式表示)。