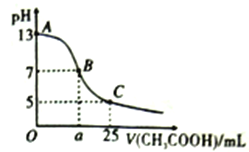
题目内容
【题目】根据如图转化关系判断下列说法不正确的是(反应条件已略去)
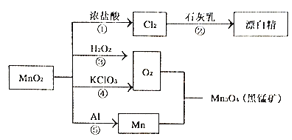
A. 反应①②③④⑤均属于氧化还原反应
B. 生成黑锰矿的反应中,3molMn参加反应转移4mol电子
C. 生成等量的O2,反应③和④转移的电子数之比为1:2
D. 反应⑤为铝热反应
【答案】B
【解析】A.①②③④⑤反应中均有元素的化合价变化,属于氧化还原反应,故A正确;B.Mn和O2反应生成黑锰矿,反应的化学方程式为:3Mn+2O2=Mn3O4,氧元素化合价0价变化为-2价,则3 molMn参加反应转移8mol电子据此计算电子转移数,故B错误;C.由6H2O2~3O2~6e-、2KClO3~3O2~12e-,生成等量的O2,反应③和④转移的电子数之比为1:2,故C正确;D.反应⑤是铝与二氧化锰的反应,属于铝热反应,故D正确;故选B。

【题目】已知某化学实验的结果如下表:
实验序号 | 反应物 | 在相同温度下测得的反 | |
大小相同的金属片 | 酸溶液 | ||
1 | 镁条 | 1 mol·L-1盐酸 | v1 |
2 | 铁片 | 1 mol·L-1盐酸 | v2 |
3 | 铁片 | 0.1 mol·L-1盐酸 | v3 |
下列结论正确的是
A.v1>v2>v3B.v3>v2>v1C.v1>v3>v2D.v2>v3>v1
【题目】二氧化硫是危害最为严重的大气污染物之一,它主要来自化石燃料的燃烧,研究CO催化还原SO2的适宜条件,在燃煤电厂的烟气脱硫中具有重要价值。
Ⅰ.从热力学角度研究反应
(1)C(s)+O2(g)= CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+172.5kJ·mol-1
S(s) +O2(g)= SO2(g) ΔH3=-296.0kJ·mol-1
请写出CO 还原SO2的热化学方程式___________________________________。
(2)对于CO还原SO2的可逆反应,下列说法正确的是_____________。
A.在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态
B.平衡状态时,2v正(CO)=v逆(SO2)
C.其他条件不变,增加SO2的浓度,CO的平衡转化率增大
D.在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
Ⅱ.探究合适的反应条件
向反应器中通入含3%SO2、6%CO和91%N2的烟气,用碘量法测定反应前后烟气中SO2的含量,反应温度区间均为300℃~500℃。
(1)催化剂和温度对反应的影响
烟气流量为0.03 L/min,分别在3种不同催化剂条件下进行实验,实验结果如下图所示。
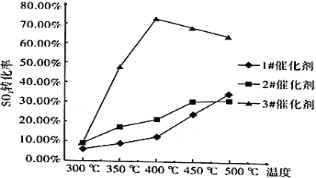
根据上图示结果,烟气除硫时选用最合适催化剂是_____________,反应温度是_______________。
(2)烟气流速对反应的影响
选用同样的催化剂,分别在三种烟气流量情况下进行实验,实验结果的数据见下表。
温度(℃) | 300 | 400 | 500 | |
SO2转化率 | 流量0.03 L/min | 25.00% | 71.40% | 65.00% |
流量 0.06 L/min | 20% | 74.20% | 62.60% | |
流量0.09 L/min | 18% | 76.30% | 60% | |
分析上表数据,①在300℃时,SO2的转化率随烟气流量变化的关系是______________,其原因可能是____________;②在400℃时,SO2的转化率随烟气流量增大而增大的原因是___________________。
Ⅲ.工业上还用Na2SO3溶液吸收SO2,将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6 时,吸收SO2的能力显著下降,此时溶液中c(HSO3-)∶(SO32-)=____________。(已知H2SO3的K1