题目内容
【题目】化学平衡移动原理在生产、生活、科研中有重要应用。
(1)生活中明矾[KAl(SO4)2·12H2O]常用作净水剂,其净水的原理是_____(用离子方程式表示)。
(2)工业上在850℃时用钠还原熔融态氯化钾的方法制备金属钾,发生的反应方程式为:Na(l) + KCl(l)![]() NaCl(l) + K(g),能制备钾的原因是_______。
NaCl(l) + K(g),能制备钾的原因是_______。
(3)测得某工厂废水中含Cr2O72–的浓度为3.0×10–4 mol·L1,常温下,对该有害离子的处理流程如下:{已知:绿矾的化学式为FeSO4·7 H2O, Ksp [Cr(OH)3]=6.0×10–31 }
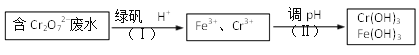
① 步骤(Ⅰ)中发生反应的离子方程式为_________。
② 若忽略加入各种试剂后的废水体积变化,则Cr3+开始沉淀的pH为_________。
(4)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:25℃时,Ksp (AgCl)=1.8×10–10,Ksp (AgI)=8.3×10–17。
操作步骤 | 现象 |
步骤1:向2 mL 0.1 mol·L1AgNO3溶液中加入2 mL 0.1 mol·L1 NaCl溶液,得到浊液a,过滤。 | 得滤液b和白色沉淀c |
步骤2:向滤液b中滴加0.1 mol·L1 KI溶液。 | 出现浑浊 |
步骤3:向白色沉淀c中滴加0.1 mol·L1 KI溶液。 | 白色沉淀变为黄色 |
① 浊液a中存在沉淀溶解平衡(用方程式表示)______________。
② 用化学平衡原理解释步骤3中的实验现象_________。
【答案】Al3+ +3H2O![]() Al(OH)3+3H+ 产生的钾蒸气逸出反应体系,使平衡右移 Cr2O72– + 6Fe3+ +14H+=2Cr3+ + 6Fe3+ + 7H2O 5 AgCl(s)
Al(OH)3+3H+ 产生的钾蒸气逸出反应体系,使平衡右移 Cr2O72– + 6Fe3+ +14H+=2Cr3+ + 6Fe3+ + 7H2O 5 AgCl(s)![]() Ag+(aq) + Cl (aq) 加入KI溶液后,因溶解度:AgI<AgCl,Ag+与I反应:Ag++I=AgI↓生成AgI黄色沉淀,AgCl的溶解平衡正向移动
Ag+(aq) + Cl (aq) 加入KI溶液后,因溶解度:AgI<AgCl,Ag+与I反应:Ag++I=AgI↓生成AgI黄色沉淀,AgCl的溶解平衡正向移动
【解析】
(1)明矾净水利用的是明矾中的铝离子可以水解生成氢氧化铝,氢氧化铝胶体具有吸附作用;
(2)由题中信息可知在850℃时钾元素以气态的形式脱离反应体系;
(3)①由工业流程线可知步骤(Ⅰ)中Cr2O72–和二价铁离子反应,生成铁离子和三价铬离子;
②利用物质的Ksp进行计算;
(4)①沉淀为AgCl利用物质的溶解平衡解释;
②步骤3中白色沉淀为AgCl黄色沉淀为AgI;
(1)明矾净水利用的是明矾中的铝离子可以水解![]() ,氢氧化铝胶体具有吸附作用;
,氢氧化铝胶体具有吸附作用;
(2)由Na(l) + KCl(l)![]() NaCl(l) + K(g)可知在850℃时钾元素以气态的形式脱离反应体系,平衡右移;
NaCl(l) + K(g)可知在850℃时钾元素以气态的形式脱离反应体系,平衡右移;
(3)①由工业流程线可知步骤(Ⅰ)中Cr2O72–和二价铁离子反应,Cr2O72– + 6Fe3+ +14H+=2Cr3+ + 6Fe3+ + 7H2O;
②利用物质的Ksp进行计算可得:Ksp [Cr(OH)3]=![]() = 6.0×10–31可知
= 6.0×10–31可知![]() ,故pH=5;
,故pH=5;
(4)①AgCl(s)![]() Ag+(aq) + Cl (aq);
Ag+(aq) + Cl (aq);
②步骤3中白色沉淀为AgCl黄色沉淀为AgI,加入KI溶液后,因溶解度:AgI<AgCl,Ag+与I反应:Ag++I=AgI↓,因生成AgI黄色沉淀,AgCl的溶解平衡正向移动。