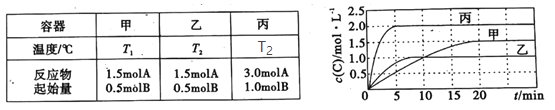
��Ŀ����
����Ŀ��(1)25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH=6������Һ��c(CH3COO��)��c(Na+)=________(��ȷ��ֵ)��
(2)25��ʱ����a molL��1�Ĵ�����b molL��1�������Ƶ������ϣ���Ӧ����Һǡ�������ԣ���a��b��ʾ����ĵ���ƽ�ⳣ��Ϊ___________________________________��
(3)д��ʹ����ĭ�����ʱ������Ӧ�����ӷ���ʽ_________________________________��
(4)������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ���Һ��_______(������������������������������)����Һ��c(Na��) _______c(CH3COO��)(���� >�� �� ����������<��)��
(5)pH��3�Ĵ����pH��11������������Һ�������Ϻ���Һ��_______(������������������������������)��
(6)25��ʱ�����ΪVa��pH=a��ijһԪǿ����Һ�����ΪVb��pH=b��ijһԪǿ����Һ���Ȼ�Ϻ���Һ��pH=7����֪b=2a��Va��Vb����a��ȡֵ��ΧΪ________��
(7)����a������ b������ c�������������ȫ�кͺ������ʵ�����NaOH����Һ��������ͬpH��������������Һ������ɴ�С��˳����______��
���𰸡�9.9��10-7mol��L��1 ![]() Al3++3HCO3��= Al(OH)3��+ 3CO2�� ���� �� ����
Al3++3HCO3��= Al(OH)3��+ 3CO2�� ���� �� ���� ![]() <a<
<a<![]() a=b��c
a=b��c
��������
(1) pH=6����c(H+)=10-6mol/L��c(OH-)=10-8mol/L�����õ���غ㣬�������Һ��c(CH3COO��)��c(Na+)= c(H+)-c(OH-)���������ݼ��ɵó������
(2)25��ʱ����a molL��1�Ĵ�����b molL��1�������Ƶ������ϣ���Ӧ����Һǡ�������ԣ���ʱc(CH3COO-)= c(Na+)=![]() b molL��1��c(H+)=10-7mol/L��c(CH3COOH)=
b molL��1��c(H+)=10-7mol/L��c(CH3COOH)=![]() (a-b )
(a-b )
molL��1����a��b��ʾ����ĵ���ƽ�ⳣ��ΪKa=![]() ���������ݼ���������
���������ݼ���������
(3)��ĭ�����ʱ�����ķ�Ӧ��Al3+��HCO3��˫ˮ�ⷴӦ��
(4)������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ����ɴ�������Һ��CH3COO-+H2O![]() CH3COOH+OH-���ɴ˿�ȷ����Һ�����ʼ���Һ��c(Na��)��c(CH3COO��)�Ĺ�ϵ��
CH3COOH+OH-���ɴ˿�ȷ����Һ�����ʼ���Һ��c(Na��)��c(CH3COO��)�Ĺ�ϵ��
(5)pH��3�Ĵ����pH��11������������Һ�������Ϻ���Һ�д��������CH3COOH![]() CH3COO-+H+���ɴ˿�ȷ����Һ�����ʡ�
CH3COO-+H+���ɴ˿�ȷ����Һ�����ʡ�
(6)25��ʱ�����ΪVa��pH=a��ijһԪǿ����Һ�����ΪVb��pH=b��ijһԪǿ����Һ���Ȼ�Ϻ���Һ��pH=7����֪b=2a��Va��Vb����Va��10-a= Vb��10-(14-b)��![]() 10a+b-14���ɴ����a������b>7�������a>
10a+b-14���ɴ����a������b>7�������a>![]() ��������a��ȡֵ��Χ��
��������a��ȡֵ��Χ��
(7)����������pH��ͬ��������NaOH��Һ�������ͬ����Ϊ���������ᣬ������ͬpHʱ�����ʵ����������NaOH��Һ���������ɴ˿�ȷ����ȫ�кͺ������ʵ�����NaOH����Һ����������ͬpH��������������Һ������ɴ�С��˳��
(1) pH=6����c(H+)=10-6mol/L��c(OH-)=10-8mol/L�����õ���غ㣬�������Һ��c(CH3COO��)��c(Na+)= c(H+)-c(OH-)=10-6mol/L-10-8mol/L=9.9��10-7mol��L��1����Ϊ��9.9��10-7mol��L��1��
(2)25��ʱ����a molL��1�Ĵ�����b molL��1�������Ƶ������ϣ���Ӧ����Һǡ�������ԣ���ʱc(CH3COO-)= c(Na+)=![]() b molL��1��c(H+)=10-7mol/L��span>c(CH3COOH)=
b molL��1��c(H+)=10-7mol/L��span>c(CH3COOH)=![]() (a-b )
(a-b )
molL��1����a��b��ʾ����ĵ���ƽ�ⳣ��ΪKa=![]() =
=![]() ������
������![]() ��
��
(3)��ĭ�����ʱ�����ķ�Ӧ��Al3+��HCO3��˫ˮ�ⷴӦ����Ӧ�����ӷ���ʽΪAl3++3HCO3��= Al(OH)3��+ 3CO2������Ϊ��Al3++3HCO3��= Al(OH)3��+ 3CO2����
(4)������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ����ɴ�������Һ��CH3COO-+H2O![]() CH3COOH+OH-���ɴ˿�ȷ����Һ�Լ��ԣ���Һ��c(Na��)>c(CH3COO��)����Ϊ�����ԣ�>��
CH3COOH+OH-���ɴ˿�ȷ����Һ�Լ��ԣ���Һ��c(Na��)>c(CH3COO��)����Ϊ�����ԣ�>��
(5)pH��3�Ĵ����pH��11������������Һ�������Ϻ���Һ�д��������CH3COOH![]() CH3COO-+H+����Һ�����ԡ���Ϊ�����ԣ�
CH3COO-+H+����Һ�����ԡ���Ϊ�����ԣ�
(6)25��ʱ�����ΪVa��pH=a��ijһԪǿ����Һ�����ΪVb��pH=b��ijһԪǿ����Һ���Ȼ�Ϻ���Һ��pH=7����֪b=2a��Va��Vb����Va��10-a= Vb��10-(14-b)��![]() 10a+b-14<1��a+b-14<0��3a<14��a<
10a+b-14<1��a+b-14<0��3a<14��a<![]() ������b>7�������a>
������b>7�������a>![]() ��������a��ȡֵ��ΧΪ
��������a��ȡֵ��ΧΪ![]() <a<
<a<![]() ������
������![]() <a<
<a<![]() ��
��
(7)����������pH��ͬ��������NaOH��Һ�������ͬ����Ϊ���������ᣬ������ͬpHʱ�����ʵ����������NaOH��Һ���������ɴ˿�ȷ����ȫ�кͺ������ʵ�����NaOH��Һ��������ͬpH��������������Һ������ɴ�С��˳��a=b��c����Ϊ��a=b��c��

����Ŀ����ѧƽ���ƶ�ԭ�����������������������ҪӦ�á�
��1������������[KAl(SO4)2��12H2O]��������ˮ�����侻ˮ��ԭ����_____�������ӷ���ʽ��ʾ����
��2����ҵ����850��ʱ���ƻ�ԭ����̬�Ȼ��صķ����Ʊ������أ������ķ�Ӧ����ʽΪ��Na(l) + KCl(l)![]() NaCl(l) + K(g)�����Ʊ��ص�ԭ����_______��
NaCl(l) + K(g)�����Ʊ��ص�ԭ����_______��
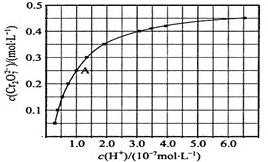
��3�����ij������ˮ�к�Cr2O72�C��Ũ��Ϊ3.0��10�C4 mol��L1�������£��Ը��к����ӵĴ����������£�{��֪���̷��Ļ�ѧʽΪFeSO4��7 H2O�� Ksp [Cr(OH)3]��6.0��10�C31 }
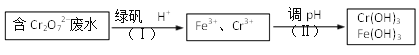
�� ����(��)�з�����Ӧ�����ӷ���ʽΪ_________��
�� �����Լ�������Լ���ķ�ˮ����仯����Cr3+��ʼ������pHΪ_________��
��4��Ϊ���о������ܽ�ƽ��ͳ���ת����ijͬѧ�������ϲ��������ʵ�顣�������ϣ�25��ʱ��Ksp (AgCl)��1.8��10�C10��Ksp (AgI)��8.3��10�C17��
�������� | ���� |
����1����2 mL 0.1 mol��L1AgNO3��Һ�м���2 mL 0.1 mol��L1 NaCl��Һ���õ���Һa�����ˡ� | ����Һb�Ͱ�ɫ����c |
����2������Һb�еμ�0.1 mol��L1 KI��Һ�� | ���ֻ��� |
����3�����ɫ����c�еμ�0.1 mol��L1 KI��Һ�� | ��ɫ������Ϊ��ɫ |
�� ��Һa�д��ڳ����ܽ�ƽ�⣨�÷���ʽ��ʾ��______________��
�� �û�ѧƽ��ԭ�����Ͳ���3�е�ʵ������_________��