题目内容
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.Na(s)![]() Na2O(s)
Na2O(s)![]() NaOH(aq)
NaOH(aq)
B.Al2O3(s)![]() AlCl3(aq)
AlCl3(aq)![]() Al(s)
Al(s)
C.CaSO4(s)![]() CaCO3(s)
CaCO3(s)![]() Ca(NO3)2(aq)
Ca(NO3)2(aq)
D.Fe2O3(s)![]() Fe(s)
Fe(s)![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)
【答案】C
【解析】
A. Na在O2中燃烧生成Na2O2,不是Na2O,A项错误;
B. Al2O3与盐酸反应生成AlCl3,电解AlCl3得不到金属Al,电解熔融状态的Al2O3能得到金属Al,B项错误;
C. CaSO4为微溶物,加入饱和的碳酸钠溶液后生成难溶的CaCO3,CaCO3溶于硝酸可得到硝酸钙,C项正确;
D. CO还原Fe2O3生成单质Fe,Fe与稀硫酸反应生成FeSO4,D项错误;
答案选C。

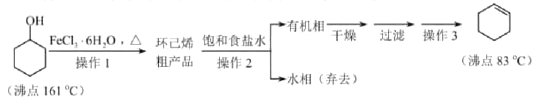
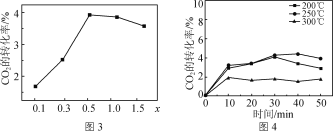
【题目】化学平衡移动原理在生产、生活、科研中有重要应用。
(1)生活中明矾[KAl(SO4)2·12H2O]常用作净水剂,其净水的原理是_____(用离子方程式表示)。
(2)工业上在850℃时用钠还原熔融态氯化钾的方法制备金属钾,发生的反应方程式为:Na(l) + KCl(l)![]() NaCl(l) + K(g),能制备钾的原因是_______。
NaCl(l) + K(g),能制备钾的原因是_______。
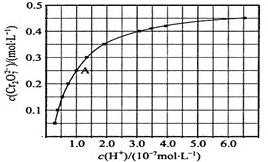
(3)测得某工厂废水中含Cr2O72–的浓度为3.0×10–4 mol·L1,常温下,对该有害离子的处理流程如下:{已知:绿矾的化学式为FeSO4·7 H2O, Ksp [Cr(OH)3]=6.0×10–31 }
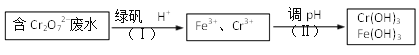
① 步骤(Ⅰ)中发生反应的离子方程式为_________。
② 若忽略加入各种试剂后的废水体积变化,则Cr3+开始沉淀的pH为_________。
(4)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:25℃时,Ksp (AgCl)=1.8×10–10,Ksp (AgI)=8.3×10–17。
操作步骤 | 现象 |
步骤1:向2 mL 0.1 mol·L1AgNO3溶液中加入2 mL 0.1 mol·L1 NaCl溶液,得到浊液a,过滤。 | 得滤液b和白色沉淀c |
步骤2:向滤液b中滴加0.1 mol·L1 KI溶液。 | 出现浑浊 |
步骤3:向白色沉淀c中滴加0.1 mol·L1 KI溶液。 | 白色沉淀变为黄色 |
① 浊液a中存在沉淀溶解平衡(用方程式表示)______________。
② 用化学平衡原理解释步骤3中的实验现象_________。
【题目】部分中学化学常见元素原子的结构、性质及用途如表所示:
元素 | 结构、性质及用途 |
A | A是一种常见的金属元素,它的一种氧化物是具有磁性的黑色晶体 |
B | B元素的一种核素可用于考古时测定一些文物的年代 |
C | C 原子最外层电子总数是次外层电子总数的3倍 |
D | D 原子的2p能级处于半充满状态 |
E | E的单质为灰黑色具有金属光泽的固体,是太阳能电池板的常用材料 |
(1)A元素基态原子的电子排布式为_______。
(2)B、C、D元素的第一电离能由大到小的顺序为______(填元素符号)。
(3)简单气态氢化物的热稳定性:C ____E(填“>”或“<”)。
(4)根据VSEPR模型预测D的氢化物的立体构型为______,中心原子D的杂化轨道类型为____;BD-中σ键与π键的数目之比为_________。
(5)足量D的氢化物水溶液与CuSO4溶液反应生成深蓝色的配离子,该配离子用结构示意图表示为___。