题目内容
7.下列各表为周期表的一部分(表中为原子序数),其中正确的是( )| A. |
| B. |
| C. |
| D. |
|
分析 相邻两个周期同主族元素的原子序数相差2、8、18、32,以此判断同族中位置关系;稀有气体元素位于元素周期表的最右侧,为0族元素,以此来解答.
解答 解:A.原11、19是碱金属元素的原子序数,应位于周期表的最左边,2号元素为零族元素,两族不相邻,位置不合理,故A错误;
B.原子序数为2的位于0族,原子序数3、11、19均为第ⅠA族,位置不合理,故B错误;
C.原子序数为6、12、14的不在同一族,位置不合理,故C错误;
D.原子序数为31的位于第ⅢA,原子序数为6、14、32位于第ⅣA族,原子序数为7的位于第ⅤA,位置合理,故D正确;
故选D.
点评 本题考查运用原子序数推导元素在周期表中的位置关系,题目难度中等,关键清楚元素周期表的结构,尤其注意0族元素的位置及常见元素的原子序数.

练习册系列答案
相关题目
8.已知柠檬醛的结构简式为: 根据已有知识判定下列说法中不正确的是( )
根据已有知识判定下列说法中不正确的是( )
 根据已有知识判定下列说法中不正确的是( )
根据已有知识判定下列说法中不正确的是( )| A. | 可使酸性高锰酸钾溶液褪色 | B. | 可跟银氨溶液反应生成银镜 | ||
| C. | 可使溴水褪色 | D. | 催化加氢后最终产物是C10H20O |
2.已知某炔烃与卤素按物质的量为1:2发生加成反应,反应后,生成的有机物至少需6mol的卤素单质才能把生成的有机物中的氢全部取代,则该炔烃可能是( )
| A. | 丙炔 | B. | 1-丁炔 | C. | 3-己炔 | D. | 2-庚炔 |
19.用一种试剂就能鉴别乙醇、乙酸、乙醛、甲酸四种物质.该试剂可以是下列中的( )
| A. | 银氨溶液 | B. | 溴水 | ||
| C. | 高锰酸钾溶液 | D. | 新制氢氧化铜悬浊液 |
16.下列叙述中正确的是( )
| A. | 周期表中第VA族元素的最高价氧化物对应水化物的化学式均为H3RO4 | |
| B. | O22-与S2-具有相同的质子数和电子数 | |
| C. | 所有主族元素的简单离子所带电荷数与其族序数相等 | |
| D. | 氕化锂、氘化锂、氚化锂可以作为“长征2号”火箭发射的重要燃料,LiH、LiD、LiT的化学性质不同 |
17.下列说法正确的是( )
| A. | CO2、CCl4、CH4三个分子中所有原子都满足最外层8电子结构 | |
| B. | 第ⅠA族的金属元素形成的单质的熔点随原子序数的递增而降低 | |
| C. | 第ⅦA族元素形成的单质的熔点随原子序数的递增而降低 | |
| D. | 第ⅠA族元素燃烧形成的氧化物中氧的化合价都不是-2 |
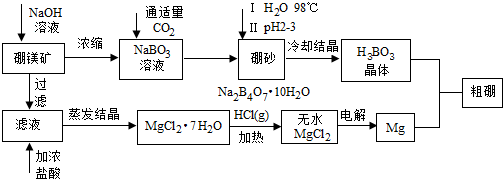
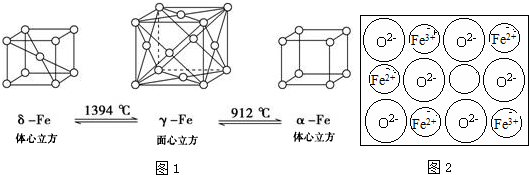
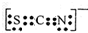 .Fe3+与SCN-可以形成配位数1~6的配离子,若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl.
.Fe3+与SCN-可以形成配位数1~6的配离子,若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl.