题目内容
20.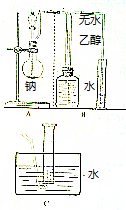 乙醇的分子式为C2H6O,有人设计了如图所示的实验来确定乙醇分子的结构.
乙醇的分子式为C2H6O,有人设计了如图所示的实验来确定乙醇分子的结构.先将装置B中广口瓶,量筒之间的导管充满水,然后在装置A中的圆底烧瓶里放入几小块金属钠(过量),从分液漏斗中缓慢地滴入一定量的无水乙醇.当乙醇完全反应后,读取量筒中水的体积(产生气体的体积小于量筒的量程).通过计算可以确定乙醇分子中被钠置换的氢原子数,进而确定乙醇分子的结构.
请填写下列空白处:
(1)为什么要从分液漏斗中缓缓地滴入无水乙醇?便于控制反应速率,使钠与乙醇充分接触完全反应.
(2)准确读取量筒中水的体积时应注意的事项是冷却至室温,量筒中液面与广口瓶中液面保持相平,读数视线与液体凹液面最低处相平.
(3)装置B可用装置C来代替.若收集气体并冷却后,量筒内最终水面处于如图所示位置,为了使体积读数准确,接着要进行的操作是移动量筒,使量筒内外液面相平.
(4)无水乙醇的密度ρ g/cm3,V mL无水乙醇与钠反应完全后,量筒内的液面读数为4mL,折合成标准状况下气体的体积a mL,则每个乙醇分子中能被钠置换出的氢原子数为(以代数式表示)$\frac{46a}{22400Vρ}$.已知含水乙醇的密度大于无水乙醇.若错把V mL含水乙醇当作无水乙醇,则测定的结果偏高(填“偏高”“偏低”或“无影响”).
分析 (1)从分液漏斗中缓缓地滴入无水乙醇,便于控制反应速率,使钠与乙醇充分接触完全反应,实验测得结果准确;
(2)准确读取量筒中水的体积应保持温度压强和室温相同,液面和广口瓶中液面相平,视线与液体凹液面最低处相平;
(3)保持压强和液面相平读取数值;
(4)微粒个数之比等于物质的量之比计算得到,若错把V mL含水乙醇当作无水乙醇,得到气体增多.
解答 解:(1)从分液漏斗中缓缓地滴入无水乙醇,便于控制反应速率,使钠与乙醇充分接触完全反应,实验测得结果准确,
故答案为:便于控制反应速率,使钠与乙醇充分接触完全反应;
(2)准确读取量筒中水的体积应保持温度压强和室温相同,液面和广口瓶中液面相平,视线与液体凹液面最低处相平,准确读取量筒中水的体积时应注意的事项是冷却至室温,量筒中液面与广口瓶中液面保持相平,读数视线与液体凹液面最低处相平;
故答案为:冷却至室温,量筒中液面与广口瓶中液面保持相平,读数视线与液体凹液面最低处相平;
(3)保持压强和液面相平读取数值,装置B可用装置C来代替.若收集气体并冷却后,量筒内最终水面处于如图所示位置,为了使体积读数准确,接着要进行的操作是移动量筒,使量筒内外液面相平,
故答案为:移动量筒,使量筒内外液面相平;
(4)微粒个数之比等于物质的量之比计算得到,$\frac{Vρ}{46}$:$\frac{a}{22400}$=1:x,x=$\frac{46a}{22400Vρ}$,
若错把V mL含水乙醇当作无水乙醇,得到气体增多,测定的结果偏高,
故答案为:$\frac{46a}{22400Vρ}$;偏高.
点评 本题考查了物质组成结构的实验测定分析判断,主要是实验基本操作和实验注意问题,掌握基础是关键,题目难度中等.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
7.以下离子:①H+ ②Cl- ③Al3+ ④K+ ⑤SO42- ⑥OH- ⑦NO3-⑧NH4+中,不影响水的电离平衡的是( )
| A. | ②④⑤⑦ | B. | ②④⑥⑦ | C. | ①⑤⑥⑦ | D. | ②④⑥⑧ |
4.下列说法不正确的是( )
| A. | 甘氨酸与丙氨酸在一定条件下发生取代反应,最多可以获得四种二肽 | |
| B. | 煤的干馏得到的煤焦油中可以分离出苯及苯的同系物,也可以分离出丙烯等石油化工原料 | |
| C. | 用原子吸收光谱可以确定物质中含有哪些金属元素 | |
| D. | 淀粉、麦芽糖水解后的最终产物都是葡萄糖 |
5.如图是一些常见有机物的转化关系,下列说法正确的是( )
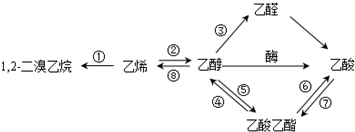

| A. | 反应①是加成反应,反应⑧是消去反应,其它所标明的反应都是取代反应 | |
| B. | 上述物质中能与NaOH溶液反应的只有乙酸 | |
| C. | 1,2一二溴乙烷、乙烯、乙醇烃基上的氢被氯取代,其一氯取代产物都是一种 | |
| D. | 等物质的量的乙烯和乙醇与足量氧气反应时耗氧量相同 |
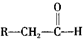 ,化学式为C8H8O2的有机物有如下的转化关系:
,化学式为C8H8O2的有机物有如下的转化关系: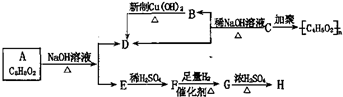
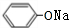 ,BCH3CHO.
,BCH3CHO.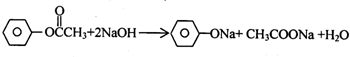 .
.