题目内容
14.铷和另一种碱金属形成的合金7.8g与足量的水反应后,产生0.2g氢气,则此合金中另一碱金属可能是:Li或Na.(铷的相对原子量取85.5)分析 钾和另一种碱金属在化合物中的化合价均为+1价,由2M+2H2O═2MOH+H2↑计算出金属的物质的量,再计算出合金的平均摩尔质量,利用平均摩尔质量的进行判断.
解答 解:0.2g氢气的物质的量为:$\frac{0.2g}{2g/mol}$=0.1mol,则
2M+2H2O═2MOH+H2↑,
2 1
0.2mol 0.1mol
则合金的平均摩尔质量为:M=$\frac{7.8g}{0.2mol}$=39g/mol,
铷的相对原子量取85.5,则铷的摩尔质量为85.5g/mol,则另一种碱金属的摩尔质量一定小于39g/mol,
故另一碱金属可能是Li或Na,
故答案为:Li或Na.
点评 本题考查了混合物反应的计算,题目难度中等,明确平均摩尔质量的含义及应用方法为解答关键,注意掌握碱金属元素的种类及化学性质,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
4.下列各组元素最高价氧化物对应水化物碱性渐弱,酸性渐强的是( )
| A. | NaOH、Mg(OH)2、H3PO4、H2SO4 | B. | NaOH、KOH、H2SO4、HClO4 | ||
| C. | Be(OH)2、Ca(OH)2、HBrO4、HClO4 | D. | Mg(OH)2、Ba(OH)2、H3PO4、H2SO4 |
5.当萘与H2以物质的量比为1:1发生加成反应时,与1,3-丁二烯发生1,4-加成相似的产物有( )
① ②
②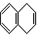 ③
③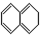 ④
④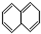
①
 ②
② ③
③ ④
④
| A. | ①③ | B. | ②④ | C. | ②③ | D. | ①④ |
2.下列说法中错误的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 化学反应中的能量变化通常表现为热量的变化 | |
| D. | 反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
9.下列有关叙述正确的是( )
| A. | H、D、T具有相同的质子数,是氢元素的三种同位素 | |
| B. | OH-与H3O+组成元素相同,所含质子数相同 | |
| C. | 结构示意图为 和 和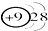 两种粒子为同一种元素 两种粒子为同一种元素 | |
| D. | 元素原子最外层电子数的多少是判断金属性和非金属性强弱的依据 |
19.关于如图所示装置的叙述,错误的是( )
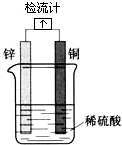

| A. | 锌是负极,其质量逐渐减轻 | |
| B. | 氢离子在铜的表面被还原,产生气泡 | |
| C. | 检流计的指针向右偏转 | |
| D. | 电流从锌片经导线流向铜片 |
6.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 4.6gNO2和N2O4的混合气体中氧原子数小于0.2NA | |
| B. | 1 L 0.1 mol.L-1的Na2S溶液中离子总数小于0.3NA | |
| C. | 在标况下,2.24 L CCl4含有0.4NA个Cl原子 | |
| D. | 0.1 mol H2O2参加氧化还原反应时,不一定转移0.2NA个电子 |
18.下表列出了A~R9种元素在周期表中的位置
用元素符号填写下空:
(1)化学性质最不活泼的元素是Ar
(2)这9中元素中金属性最强的是K
(3)A在F中燃烧得到产物的化学式Na2O2
(4)G的最高价含氧酸的化学式是HCl04
(5)C与D的原子半径比较:R(D)< R(C)(填“>”或“<”)
(6)E的最简单氢化物的化学式CH4.
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | VA | VIA | VⅡA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(1)化学性质最不活泼的元素是Ar
(2)这9中元素中金属性最强的是K
(3)A在F中燃烧得到产物的化学式Na2O2
(4)G的最高价含氧酸的化学式是HCl04
(5)C与D的原子半径比较:R(D)< R(C)(填“>”或“<”)
(6)E的最简单氢化物的化学式CH4.
 .
.