题目内容
19.关于如图所示装置的叙述,错误的是( )
| A. | 锌是负极,其质量逐渐减轻 | |
| B. | 氢离子在铜的表面被还原,产生气泡 | |
| C. | 检流计的指针向右偏转 | |
| D. | 电流从锌片经导线流向铜片 |
分析 该原电池中,较活泼的金属锌作负极,负极上失电子生成锌离子进入溶液;较不活泼的金属铜作正极,正极上氢离子得电子生成氢气;电子从负极沿导线流向正极,电流流向和电子流向相反,以此解答该题.
解答 解:A.锌是负极,锌失电子生成锌离子进入溶液,所以质量逐渐减小,故A正确;
B.铜是正极,正极上氢离子得电子发生还原反应生成氢气,所以氢离子在铜表面被还原,故B正确;
C.该实验中只能证明检流计指针发生偏转,但不能确定偏转方向,故C错误;
D.电子从负极沿导线流向正极,所以电子从锌片经导线流向铜片,而电流从正极流向负极,故D错误;
故选CD.
点评 本题考查了原电池原理,为高频考点,侧重于学生的分析能力的考查,难度不大,注意把握原电池的工作原理.

练习册系列答案
相关题目
9.在实验室中常以草酸钠(Na2C2O4)为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化学方程式为:C2O42-+MnO4-+H+-→Mn2++CO2↑+H2O.下列有关草酸钠滴定高锰酸钾实验的叙述,正确的是( )
| A. | 滴定过程中,高锰酸钾被氧化,草酸钠被还原 | |
| B. | 用酸式滴定管量取草酸钠溶液 | |
| C. | 该反应中,消耗的草酸钠与高锰酸钾的物质的量之比为5:2 | |
| D. | 为便于滴定终点的判断,滴定时必须往体系中加入指示剂 |
10.下列有关叙述正确的是( )
| A. | 只含有离子键的化合物才是离子化合物 | |
| B. | 硫酸铵晶体是含有离子键、极性键和配位键的分子晶体 | |
| C. | 由于I-I键的键能比F-F、Cl-Cl、Br-Br键的键能都小,所以在卤素单质中碘的熔点最低 | |
| D. | 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键 |
7.一定条件下,发生可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)下列叙述中,不能做为此可逆反应已经达到化学平衡状态的标志是( )
| A. | NH3的消耗速率等于NO的生成速率 | |
| B. | NH3的消耗速率等于NO的消耗速率 | |
| C. | NH3的浓度和NO的浓度都不发生改变 | |
| D. | 密闭容器内的压强不发生改变 |
4.下列有关物质用途的说法正确的是( )
| A. | 明矾可用作净水剂 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 晶体硅可用于制造光导纤维 | D. | 铝制容器可长期存放酸性食物 |
5.工业上以锂辉石(Li2O•A12O3•4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂.其部分工艺流程如下:

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250℃~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②某些物质的溶解度(S)如下表所示.ⅠⅡⅢ
(1)从滤渣1中分离出Al2O3的部分流程图所示,括号表示加入的试剂,方框表示所得到的物质.则步骤Ⅱ中最佳反应的离子方程式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
滤渣1$→_{Ⅰ}^{()}$□$→_{Ⅱ}^{()}$□$→_{Ⅲ}^{灼烧}$Al2O3
(2)已知滤液1中的主要离子为Li+、Mg2+、Ca2+、SO42-,滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述,并写离子方程式)增加Ca2+、OH-的浓度,有利于Mg(OH)2、CaCO3的析出;Mg2++Ca(OH)2=Mg(OH)2+Ca2+.
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3=Li2CO3+NH3•H2O+H2O.

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250℃~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②某些物质的溶解度(S)如下表所示.ⅠⅡⅢ
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
滤渣1$→_{Ⅰ}^{()}$□$→_{Ⅱ}^{()}$□$→_{Ⅲ}^{灼烧}$Al2O3
(2)已知滤液1中的主要离子为Li+、Mg2+、Ca2+、SO42-,滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述,并写离子方程式)增加Ca2+、OH-的浓度,有利于Mg(OH)2、CaCO3的析出;Mg2++Ca(OH)2=Mg(OH)2+Ca2+.
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3=Li2CO3+NH3•H2O+H2O.
2.下列物质熔沸点高低的比较,正确的是( )
| A. | HF>HI | B. | CCl4<CF4 | C. | SiO2<CO2 | D. | NaCl<KCl |
3.下列物质在一定条件下,不能和H2发生加成反应的是( )
| A. | CH3CH2CHO | B. | 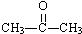 | C. | CH2=CHCOOH | D. | CH3COOCH3 |