��Ŀ����
����Ŀ��ʮ�Ŵ������Ҫ����Ӯ���챣��ս������ζ�Ŷ���Ⱦ���αȹ�ȥҪ����ߡ�ij������������Һʵ�ַ��硢������λһ���ϵ�װ��ʾ��ͼ���£�����װ�ù���ʱ������˵����ȷ����( )
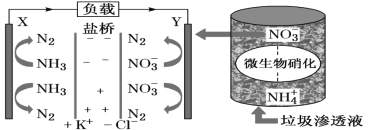
A.������Cl-��Y���ƶ�
B.Y�������ķ�ӦΪ2NO3����10e-��6H2O=N2����12OH-����ΧpH����
C.������X���ص�������Y��
D.��·������7.5mol����ʱ����������״����N2�����Ϊ16.8L
���𰸡�B
��������
���ݴ�����������Һ�����䷢���ʾ��ͼ��֪��װ������ԭ���װ�ã�X�Ǹ���������ʧ���ӵ�������Ӧ��Y�������������õ��ӵĻ�ԭ��Ӧ2 NO3����10e-��6H2O=N2����12OH-�����������������������������������������ӴӸ�������������
A��������������Һ��װ������ԭ���װ�ã���Һ�е�����������������������X���ƶ���A����
B��Y�������������õ��ӵĻ�ԭ��Ӧ��2NO3����10e-��6H2O=N2����12OH-����ΧpH����B��ȷ��
C��������������������Y���ص�������X����C����
D������ܷ�ӦΪ��5NH3��3NO3��=4N2��6H2O��3OH�����÷�Ӧת����15mol���ӣ�����4molN2���ʵ�·������7.5mol����ʱ������2molN2����״�������Ϊ44.8L��D����
��ѡB��

����Ŀ���о�������Ⱦ��Ĵ������Ի��������������Ⱦ������������������ĵ�����ʮ����Ҫ�����塣
(1)��֪��C(s)+O2(g)�TCO2(g)��H����393.5/kJmol
N2(g)+O2(g)�T2NO(g)��H��+180kJ/mol
��C(s)+2NO(g)�TCO2(g)+N2(g) ����H��_____kJ/mol��
(2)��һ���¶��£���2L�ĺ����ܱ������г���4.0 mol NO2��4.0 mol CO���ڴ��������·�����Ӧ4CO(g)+2NO2(g)4CO2(g)+N2(g)�����������������ʾ��
t/min | 0 | 5 | 10 | 15 | 20 |
n(NO2)/mol | 4.0 | 3.4 | 3.12 | 3.0 | 3.0 |
n(N2)/mol | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
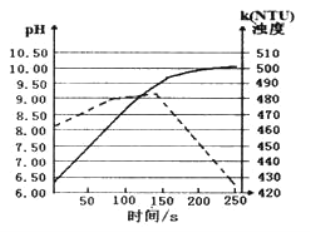
����0��5 min�ڣ���CO2��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ_____��
�ڴ��¶��µĻ�ѧƽ�ⳣ��K�ı���ʽΪ_____��
(3)�û���̿��ԭ��������������йط�ӦΪC(s)+2NO(g)![]() CO2(g)+N2(g)��ij�о�С����2L�ܱ������м��������Ļ���̿��һ������NO�������¶Ⱥ�������䣬����������Ӧ��
CO2(g)+N2(g)��ij�о�С����2L�ܱ������м��������Ļ���̿��һ������NO�������¶Ⱥ�������䣬����������Ӧ��
������������˵��������Ӧ�Ѵ�ƽ�����_____(����)��
A.����̿���������ٱ仯
B.������������ܶȱ��ֲ���
C.2v(NO)�� ��v(N2)��
D. ���ֲ���
���ֲ���
��ѹǿΪpʱ�������Ĵ�Ч�ʡ������������������¶ȵĹ�ϵ��ͼ��ʾ��������������������Ҫȡ�����¶�ʱ����Ӧ���¶ȷ�Χ��_____��
(4)��(N2H4)����ɫҺ�壬����ǿ��ԭ�ԡ�
���µ�ˮ��Һ�������ԣ�����������NH3H2O���ƣ����һ�����뷽��ʽΪ_____��
������N2H4ȼ�ϵ�ز���Ի���û����Ⱦ���õ���Թ���������Ϊ�����(�ܴ���O2��)��д�������ĵ缫��Ӧʽ_____��
����Ŀ����������أ�KBe2BO3F2���Ǽ������ĺ��IJ��ϣ��ҹ���ѧ���ڴ�������о��������������ǰ�С��ش��������⣺
(1)����������зǽ���Ԫ��ԭ�ӵĵ縺�Դ�С˳����______________����̬K+�ĵ����Ų�ʽΪ__________________��
(2)NaBH4���л��ϳ��г��õĻ�ԭ�������е������ӿռ乹����_______________������ԭ�ӵ��ӻ���ʽΪ__________��NaBH4�д���__________�����ţ���
a.���Ӽ� b.��� c.���� d.����
(3)BeCl2�еĻ�ѧ���������ԵĹ����ԣ�����״̬����˫�۷��Ӵ��ڵ�BeCl2�ĽṹʽΪ_________________��
��4����������Ԫ�ط�������۵����±���
������ | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
�۵�/�� | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
���ͱ��з������۵�仯��ԭ��__________________________��
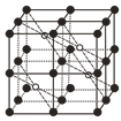
(5)CaF2��һ�־�����ͼ��ʾ��Ca2+ռ��F-�γɵĿ�϶����r(F-)=x pm��r(Ca2+)=y pm���谢���ӵ�������ֵΪNA����CaF2���ܶ���=____________________g��cm-3���г��������ʽ����