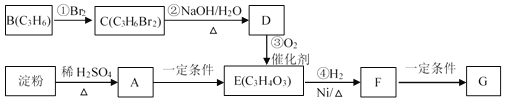
题目内容
【题目】现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥E、C同主族,且E比C多两个电子层,E单质可与冷水反应生成氢气.
试回答:
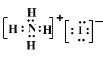
(1)A在元素周期表中的位置___,B的离子结构示意图___,化合物NH4D(含D-的铵盐)的电子式___。
(2)C的某种简单阳离子,其原子核中含22个中子,其化学符号为___;元素D最高价氧化物的水化物化学式为___。
(3)B、C、E三种元素的金属性按照由强到弱的顺序排列应为:___(用元素符号表示)。
(4)写出单质B和氢氧化钠溶液反应的离子方程式:___。
(5)写出E与冷水反应的离子方程式:___。
【答案】第二周期第ⅥA族 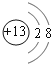
![]() K+ HIO4 Cs>K>Al 2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Cs+2H2O=2Cs++2OH-+H2↑
K+ HIO4 Cs>K>Al 2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Cs+2H2O=2Cs++2OH-+H2↑
【解析】
A、B、C、D、E五种元素它们的质子数依次增多,①A的核电荷数大于2可形成氢化物H2A该氢化物在常温下是液体则A为氧元素;②A和B两元素可形成B2A3化合物该化合物既能溶于强酸又能溶于强碱则B为铝元素;③B为铝元素,C+离子比B3+离子多8个电子则C为钾元素;④C与D元素可以形成化合物CD;⑤CD的溶液中通入氯气后加淀粉溶液显蓝色,则D为碘元素;⑥C为钾元素在周期表中E处于C的下两个周期E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1则E为+1价金属与钾元素同主族,则E为Cs元素,据此分析解答。
(1)根据上述分析可知,A为O元素,是第8号元素,位于元素周期表的第二周期第ⅥA族,B为Al元素,核电荷数为13,其离子结构示意图为 ,D为I元素,化合物NH4I为离子化合物,电子式为
,D为I元素,化合物NH4I为离子化合物,电子式为 ,故答案为:第二周期第ⅥA族;
,故答案为:第二周期第ⅥA族; ;
; ;
;
(2)C为K元素,质子数为19,根据质量数=质子数+中子数可知,K的某种简单阳离子,其原子核中含22个中子,其化学符号为![]() K+,故答案为:
K+,故答案为:![]() K+;
K+;
(3)同一周期元素金属性从左至右依次减弱,则金属性:Na>Al,同一主族元素金属性至上而下金属性依次增强,则金属性:Cs>K>Na,因此金属性:Cs>K>Al,故答案为:Cs>K>Al;
(4)B为Al元素,Al单质具有两性,与氢氧化钠溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)Cs还原性很强,可将冷水中的氢还原为氢气,其离子反应方程式为2Cs+2H2O=2Cs++2OH-+H2↑,故答案为:2Cs+2H2O=2Cs++2OH-+H2↑。

【题目】以黄铜矿(主要成分为 CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要工艺流程如下:
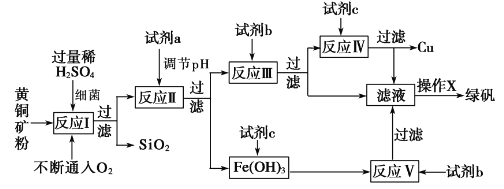
已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表。
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
下列说法不正确的是
A. 试剂a可以是CuO或Cu(OH)2,作用是调节pH至3.7~4.7之间
B. 反应I的化学反应方程式为4 CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O,该反应中铁元素被还原
C. 操作X为蒸发浓缩至溶液表面出现晶膜,再冷却结晶
D. 反应Ⅲ的离子方程式为Cu2++Fe==Cu+Fe2+,试剂c参与反应的离子方程式分别为Fe+2H+=Fe2++H2↑,Fe(OH)3+3H+=Fe 3++3H2O