题目内容
【题目】浓硫酸分别与三种钠盐反应,现象如图。下列分析正确的是( )
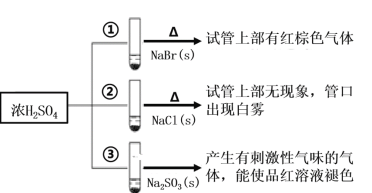
A.②中试管口白雾是HCl遇水蒸气所致,说明酸性:H2SO4>HCl
B.①和③相比可说明氧化性:Br2>SO2
C.对比①和②可以说明还原性:Br->Cl-
D.③中浓H2SO4被还原成SO2
【答案】C
【解析】
A、利用浓硫酸高沸点,HCl易挥发,反应②利用高沸点酸制取低沸点酸,不能得出酸性强弱,A选项错误;
B、反应①出现红棕色气体,说明产生Br2(g),Br-被氧化;反应③产生的气体为SO2,反应③发生Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,不属于氧化还原反应,不能说明Br2的氧化性强于SO2,B选项错误;
C、反应①出现红棕色气体,说明产生Br2(g),Br-被氧化,反应②管口出现白雾,白雾是HCl的小液滴,Cl-没有被氧化,说明Br-的还原性强于Cl-,C选项正确;
D、反应③的方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,不属于氧化还原反应,D选项错误;
答案选C。

练习册系列答案
相关题目